
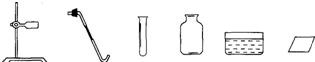
 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑; 2H2O+O2↑,则可知过氧化氢的相对分子质量为34,而氢元素与氧元素的质量比为1:16;根据过氧化氢中氢元素和氧元素的质量分数,可求34克过氧化氢中氧元素的质量为34×
2H2O+O2↑,则可知过氧化氢的相对分子质量为34,而氢元素与氧元素的质量比为1:16;根据过氧化氢中氢元素和氧元素的质量分数,可求34克过氧化氢中氧元素的质量为34×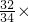 100%=32克;根据化学方程式可求生成氧气的质量为16克;根据质量守恒定律,双氧水的氧元素分别进入生成物水和氧气中了,故(m1一m2)则表示生成物水中氧元素的质量.
100%=32克;根据化学方程式可求生成氧气的质量为16克;根据质量守恒定律,双氧水的氧元素分别进入生成物水和氧气中了,故(m1一m2)则表示生成物水中氧元素的质量. K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑; 2H2O+O2↑,则可知过氧化氢的相对分子质量,氢元素与氧元素的质量比;根据过氧化氢中氢元素和氧元素的质量分数,可求34克过氧化氢中氢元素、氧元素的质量;根据化学方程式可求生成氧气的质量;根据质量守恒定律,(m1一m2)则表示生成物水中氧元素的质量.
2H2O+O2↑,则可知过氧化氢的相对分子质量,氢元素与氧元素的质量比;根据过氧化氢中氢元素和氧元素的质量分数,可求34克过氧化氢中氢元素、氧元素的质量;根据化学方程式可求生成氧气的质量;根据质量守恒定律,(m1一m2)则表示生成物水中氧元素的质量.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

| 加热 |
| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com