


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
A、镁在空气中燃烧:2Mg+O2
| ||||
B、一氧化碳还原氧化铁:3CO+Fe2O3
| ||||
| C、铁和稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑ | ||||
| D、用氢氧化钙中和硫酸厂的废水:Ca(OH)2+H2SO4=CaSO4+2H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:
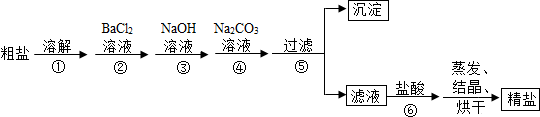
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
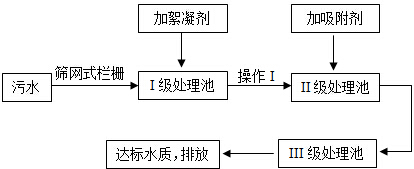
查看答案和解析>>
科目:初中化学 来源: 题型:
| 操作 | 现象 | 结论 |
| ①取洗净后的白色固体,加入足量的 |
观察到 |
白色固体一定含有MgCO3 |
| ②秤取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:
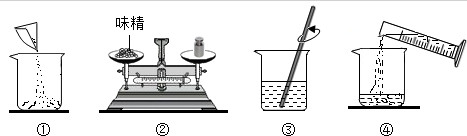
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com