
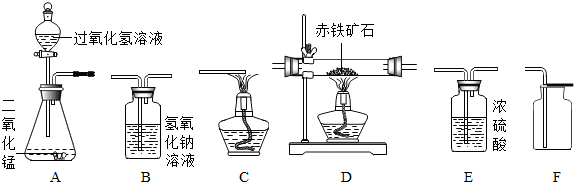
分析 (1)以过氧化氢溶液为原料制备氧气时,不需要加热,浓硫酸具有吸水性,用排气法可以收集干燥的气体;
(2)①一氧化碳还原氧化铁生成铁和二氧化碳,氧化铁是红色的,铁粉是黑色的;
②根据B洗气瓶中氢氧化钠的质量用来吸收二氧化碳,通过测量反应前、后B洗气瓶中氢氧化钠的质量变化来计算氧化铁样品的纯度,如果不连接仪器B1,混合气体中二氧化碳会进入B2,B2中二氧化碳的质量变大解答;
③根据反应前、后D处大玻璃管减少的质量即为参加反应的氧化铁中氧元素的质量解答;
④一氧化碳有毒,不反应的一氧化碳要进行尾气处理,防止污染大气.
解答 解:(1)①欲在实验室中制备并收集干燥的氧气,所选仪器的连接顺序为A、E、F,通过A装置,利用过氧化氢溶液制取氧气,通过E装置中的浓硫酸干燥氧气,再通过F装置收集干燥的氧气;
②过氧化氢在催化剂的催化作用下,能生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③氧气的密度比空气的大,收集气体时,导气管要伸到集气瓶底部的目的是便于收集到比较纯净的气体;
(2)①一氧化碳还原氧化铁生成铁和二氧化碳,氧化铁是红色的,铁粉是黑色的,故D中看到的现象是红色粉末变为红色,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②B洗气瓶中氢氧化钠的质量用来吸收二氧化碳,通过测量反应前、后B洗气瓶中氢氧化钠的质量变化来计算氧化铁样品的纯度,如果不连接仪器B1,混合气体中二氧化碳会进入B2,B2中二氧化碳的质量变大,则这样计算出的氧化铁含量与实际值比较将偏大;
③反应前、后D处大玻璃管减少的质量即为参加反应的氧化铁中氧元素的质量,B2装置放的是氢氧化钠溶液,可与一氧化碳和氧化铁反应生成的二氧化碳充分反应,故该装置增加的质量即是反应生成的二氧化碳的质量;二氧化碳中一个氧原子的质量就是仪器D中固体减少的质量,若仪器B1中溶液增加的质量与仪器D中固体减少的质量相等,那么仪器B1中溶液增加质量与仪器B2中溶液增加质量之比为:16:44=4:11;
④一氧化碳有毒,不反应的一氧化碳要进行尾气处理,防止污染大气,先点燃装置C处酒精灯的原因是防止先通入的一氧化碳污染空气
故答案为:
(1)①A E F; ②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;③排净空气,使收集到的气体更纯净;(2)①红色固体变成黑色固体; Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;②偏大;③4:11;④点燃尾气,防止一氧化碳污染空气.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 化学符号 | (1)2N2 | 3H | (3)NO3- | 氧化铜中铜元素化合价 |
| 符号的意义 | 2个氮分子 | (2)3个氢原子 | 硝酸根离子 | (4)$\stackrel{+2}{Cu}$O |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 现象 | 结论 |
| 实验1:取滤渣乙加入盐酸 | 无气体产生 | 滤渣乙可能是银或铜和银 |
| 实验2:取滤液甲加入氢氧化钠 | 无蓝色沉淀 | 滤渣乙一定是铜和银 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁条燃烧后质量增加,不遵守质量守恒定律 | |
| B. | 5g硫和5g氧气完全反应后,生成物质量为10g,遵守质量守恒定律 | |
| C. | 5g水和5g酒精混合后,总质量为10g,遵守质量守恒定律 | |
| D. | 化学反应前后分子总数一定不会发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com