
分析 (1)根据氯气与氢氧化钠溶液反应原理书写方程式,并依据化合物中正负化合价总和为0的原则解答;
(2)根据实验室制取气体的一般思路:选择发生装置时要考虑反应物的状态和反应条件进行回答;
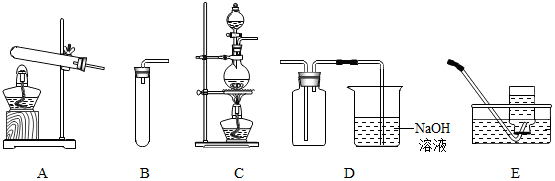
(3)根据反应物的状态和反应条件选择制取氯气的发生装置,氯气有毒,所以要进行尾气处理,并依据氯气可与氢氧化钠溶液反应分析解答;
(4)B、E组合在实验室可制取用固体和液体不需加热制取、且不易溶于水的气体,再根据反应原理书写方程式;
(5)根据大理石与稀盐酸反应方程式,依据二氧化碳气体的质量计算碳酸钙的质量,并进而求出大理石中杂质的质量分数.
解答 解:(1)氯气能与氢氧化钠溶液反应,生成氯化钠、次氯酸钠(NaClO)和水,方程式是Cl2+2NaOH═NaCl+NaClO+H2O,氯化钠中钠元素显+1价,所以氯元素显-1价,次氯酸钠中钠元素显+1价,氧元素显-2价,所以氯元素显+1价;
(2)此题考查实验室制取气体的思路,选择发生装置时要考虑反应物的状态和反应条件;
(3)根据(2)中分析选择发生装置要考虑反应物的状态和反应条件,因实验室制取氯气是用加热二氧化锰和浓盐酸的方法,即反应物为固体和液体,反应的条件为加热,所以应选C装置,由于氯气有毒,并能与氢氧化钠反应,故可用氢氧化钠溶液吸收多余的氯气;
故答案为:C;吸收多余的氯气;
(4)B、E组合在实验室可制取用固体和液体不需加热制取、且不易溶于水的气体,实验室用双氧水制取氧气及用锌与稀硫酸反应制取氢气符合条件,氢气和氧气都不溶于水,双氧水和二氧化锰混合生成水和氧气,方程式是 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,锌与稀硫酸反应生成硫酸锌,方程式是Zn+H2SO4═ZnSO4+H2↑;
故答案为:氧气;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(或氢气;Zn+H2SO4═ZnSO4+H2↑)
(5)设CaCO3 的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}=\frac{44}{4.4g}$
x=10g
大理石中杂质的质量分数为=$\frac{12.5g-10g}{12.5g}$×100%=20%
答案:
(1)Cl2+2NaOH═NaCl+NaClO+H2O;-1、+1
(2)反应物的状态和反应的条件.
(3)C;吸收多余的氯气;
(4)氧气;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(或氢气;Zn+H2SO4═ZnSO4+H2↑)
(5)大理石中杂质的质量分数为20%.
点评 本题考查知识综合而全面,既考查了实验室制取气体的思路及理解应用,又考查了实验室制取气体的反应方程式和方程式计算等内容,能很好的考查学生应用知识解决问题 的能力.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com