
分析 据锌的质量结合方程式计算生成氢气的质量,生成的氯化锌的质量,反应后溶液的质量=反应前各组份的质量之和-气体的质量,并据溶质的质量分数计算即可.
解答 解:(1)设生成氢气的质量为x,生成氯化锌的质量为y
Zn+2HCl═ZnCl2+H2↑
65 136 2
6.5g y x
$\frac{65g}{6.5g}=\frac{136}{y}=\frac{2}{x}$
x=0.2g
y=13.6g
(2)反应后所得氯化锌溶液的溶质质量分数=$\frac{13.6g}{100g+6.5g-0.2g}$×100%=12.8%
答:(1)生成氢气的质量为0.2g;
(2)反应后所得溶液中溶质的质量分数为12.8%.
点评 根据质量守恒定律,反应后所得溶液的质量=参加反应金属的质量+加入的稀盐酸的质量-放出气体的质量,并掌握方程式计算的解题格式,溶质的质量分数的计算方法.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:解答题
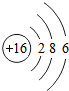 ⑤
⑤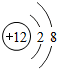
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
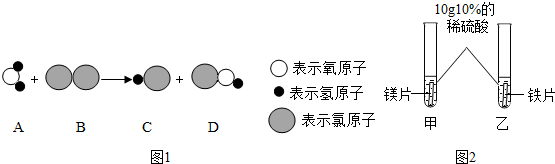
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 同一物质:火碱,纯碱,苛性钠 | B. | 复合肥料:氯化铵、磷矿粉、硝酸钾 | ||
| C. | 化石燃料:煤、石油、天然气 | D. | 混合物:氢气、石灰石、空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 维生素 | B. | 脂肪 | C. | 蛋白质 | D. | 糖类 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
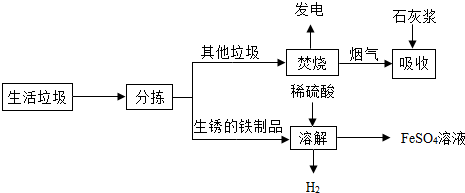
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com