
| A. | 用盐酸除去铁钉表面的铁锈 | B. | 氢氧化钙可用作建筑材料 | ||
| C. | 碳酸氢钠可以治疗胃酸过多 | D. | 浓硫酸可以作食品干燥剂 |
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
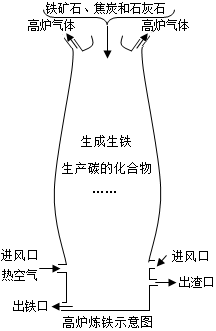 近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答:
近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 某溶液中含有Cu(NO3)2和AgNO3,现向其中逐渐加入一定质量的铁粉进行处理,并绘制参加反应的铁的质量与溶液中溶质种类的关系图.下列说法不正确的是( )
某溶液中含有Cu(NO3)2和AgNO3,现向其中逐渐加入一定质量的铁粉进行处理,并绘制参加反应的铁的质量与溶液中溶质种类的关系图.下列说法不正确的是( )| A. | a点溶液中溶质为3种时,金属单质的种类也为1种 | |
| B. | 当溶质种类为2种时,金属单质种类可能为2种 | |
| C. | a、b两点,溶液的质量相等 | |
| D. | 当溶质种类为1种时,金属单质种类可能为3种 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向醋酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
| B | 向溶质质量分数为5%的过氧化氢溶液中加少量氧化铜 | 有大量气泡产生 | 氧化铜起催化作用 |
| C | 将两根铁丝分别伸入硫酸铜溶液和硝酸银溶液中 | 两根铁丝上均有固体附着 | 金属的活动性顺序为Fe>Cu>Ag |
| D | 用导管分别对准浸没在热水和冷水中的白磷通气 | 热水中的白磷燃烧,冷水中的白磷不燃烧 | 燃烧的条件之一是温度达到着火点 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
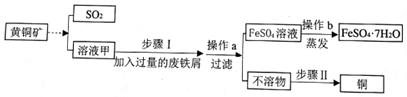
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KMnO4、CuCl2、Fe2(SO4)3、NaNO3 | B. | H2SO4、HCl、AgNO3、Na2SO4 | ||
| C. | NaNO3、NaCl、KNO3、(NH4)2SO4 | D. | K2SO4、NaCl、K2CO3、NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com