
【题目】阅读下面科普短文。
酸奶营养丰富,富含人体生长发育所必须的多种营养物质,是人们喜爱的食品。
表 1 某品牌酸奶中主要营养成分的含量(每 100 克)
蛋白质/克 | 糖类/克 | 脂肪/克 | 钠/毫克 | 钙/毫克 |
2.7 | 9.5 | 2.7 | 75 | 90 |
但是,普通酸奶含有乳糖,经调查,我国有 88.9%的成人缺乏分解乳糖的乳糖酶,有55.1%的成年人表现有乳糖不耐受症状(主要症状为腹泻)。因此,在保证普通酸奶基本营养不损失的前提下,乳糖含量较低或无乳糖的酸奶成为乳糖不耐受消费者的需求。相关科研技术人员为满足消费者的需求,开始研发无乳糖酸奶。无乳糖酸奶的工艺流程为:原料乳 → 标准化 → 添加 6%的白砂糖 → 均质 → 巴氏杀菌 → 冷却→接种发酵剂(直投式发酵剂)→ 发酵(37℃、42℃)→ 4℃低温储存。
研究一 发酵酸奶中添加乳糖酶对乳糖水解效果的影响
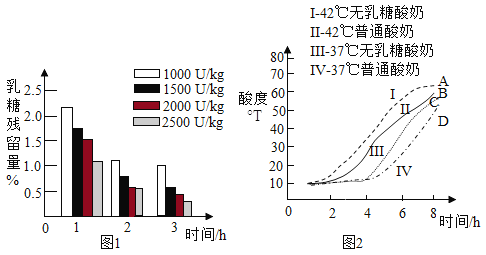
在 37℃,向普通酸奶中添加不同剂量乳糖酶(剂量分别为 1000U/kg、1500U/kg、2000U/kg、2500U/kg),发酵 3 小时,测得发酵酸奶中乳糖残留量随时间的变化,如图 1 所示。
研究二 普通酸奶和无乳糖酸奶发酵过程中的酸度变化
普通酸奶和无乳糖酸奶分别在 37℃和 42℃发酵 8 小时,发酵过程中酸度(从 1 小时开始测量)变化如图 2 所示。
除以上研究,科技人员还在口味、活菌数、保存等方面做了无乳糖酸奶与普通酸奶的对比研究,发现无乳糖酸奶都具有一定的优势。
依据文章内容回答下列问题。
(1)由表 1 可知酸奶的主要营养成分中含量最高的是_______。
(2)由图 1 可知:3 小时内,_______(填字母序号,下同)。
A添加相同量乳糖酶,发酵酸奶中乳糖残留量随时间的延长而降低
B相同发酵时间,乳糖残留量均随乳糖酶添加量的增大而降低
C乳糖残留量与温度、时间、乳糖酶添加量有关
(3)由图 2,影响无乳糖酸奶酸度的因素是_______。
(4)由图 2 可知:42℃时无乳糖酸奶发酵过程中酸度与时间的关系是_______。
(5)下列说法正确的是_______。
A我国绝大部分成年人都有乳糖不耐受症状
B表 1 中“钠”指的是钠元素
C无乳糖酸奶的工艺中至少两步属于化学变化
D无乳糖酸奶比普通酸奶适合更多消费者食用
【答案】糖类 AB 温度 42℃时,无乳糖酸奶发酵的时间越久,酸度越高 BCD
【解析】
(1)每100克酸奶中含有蛋白质2.7g,9.5g的糖类,2.7g的脂肪。则酸奶中含量最多的营养物质是糖类。故答案为:糖类;
(2)A、由图1可知,在3个小时内,相同量的乳糖,发酵酸奶中乳糖的残留量逐渐降低。A正确;
B、在相同的时间内,1000U/kg的乳糖残留量最高,2500U/kg的乳糖残留量最低。所以可以得出相同的发酵时间,乳糖残留量和糖酶的添加量增大而降低。B正确;
C、在图1中,只能分析出乳糖残留量与时间、乳糖酶的添加量有关,无法分析出温度与乳糖残留量的关系。C错误。
故答案为:AB;
(3)由图2可知,曲线Ⅰ的42℃的无乳糖酸奶的酸度和曲线Ⅲ的37℃的无乳糖酸奶的酸度有明显的不同。所以可以分析出影响无乳糖酸奶的酸度的因素是温度。故答案为:温度;
(4)由图2中的曲线Ⅰ的42℃无乳糖酸奶的时间-酸度曲线可知,时间越久,酸度越高。故答案为:42℃时,无乳糖酸奶发酵的时间越久,酸度越高;
(5)A、我国大约有55.1%的成年人表现有乳糖不耐受症,而不是绝大多数成年人。A错误;
B、在酸奶中加入对应的含有钠元素和钙元素的化合物,则表1中指的是钠元素和钙元素。B正确;
C、无乳糖酸奶的工艺步骤中,其中包括杀菌、发酵两个步骤。杀菌的过程中,消灭细菌病毒,有新物质生成,属于化学变化。发酵的过程,有物质发酵,生成新的物质,属于化学变化。所以无乳糖酸奶的工艺中至少包括两步化学变化。C正确;
D、无乳糖酸奶不仅营养不损失,而且对乳糖含量较低或无乳糖的乳糖不耐受的消费者较好,与普通的酸奶有一定的优势。D正确。
故答案为:BCD。


科目:初中化学 来源: 题型:
【题目】请根据下列装置图,回答有关问题:
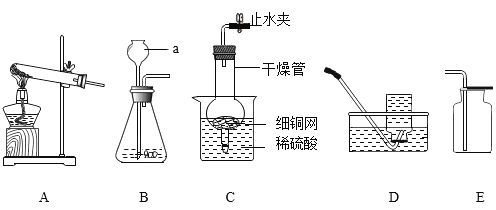
(1)写出上述标号仪器的名称:a_____。
(2)秦丽用高锰酸钾制取氧气,她选择上述装置中的A作为发生装置,你认为A装置中还缺少_____。
(3)高明设计了C装置来制取干燥的氢气,其中锌粒放在细铜网上,则该装置的显著优点是_____,此时收集装置应选择装置_____(填装置序号)。
(4)G装置是化学实验中常用的多功能瓶,若用它来干燥氧气,此时瓶中应该盛放的液体试剂是_____(填试剂名称),氧气应该从_____端通入(填“b”或“c”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。生成的是什么气体呢?同学们决定进行探究。探究前老师提示,该反应生成的气体只有一种。
(提出猜想)放出的气体可能是SO2、O2、H2,提出猜想的依据是____________________。
(查阅资料)SO2易溶于水,化学性质与二氧化碳有相似之处,它能使澄清石灰水变浑浊,生成CaSO3。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是_____________________________________。
(2)乙同学认为是SO2,则只需将放出的气体通入澄清石灰水中,看澄清石灰水是否变浑浊。写出SO2与Ca(OH)2反应的化学方程式________________________________。
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。
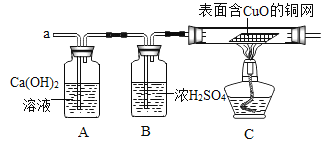
若拆去B装置,直接连接A和C装置进行实验,可能导致____________后果发生。
(实验探究)实验开始时,先将收集到的气体从a通入一段时间后,再点燃C处酒精灯;
这样操作的目的是____________________________________。
实验过程中发现A装置中溶液不变浑浊,C装置中表面含CuO的铜网由黑色变为光亮的红色;
结论:铁粉与硫酸铜溶液反应时,产生的气体是_________________。
(思维拓展)由上述实验可以推出,硫酸铜溶液中可能含有____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色粉末,可能含有Na2CO3、Na2SO4、K2SO4、KCl、Ba(OH)2中的一种或几种,为了探究其成分,实验过程如图所示,关于该实验的说法中,正确的是()
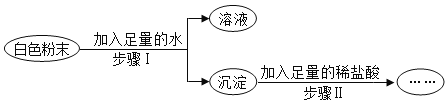
A.步骤Ⅱ中沉淀不溶解,则原白色粉末一定有K2SO4,一定没有Na2CO3
B.步骤Ⅱ中沉淀全部溶解,则原白色粉末一定有Ba(OH)2、Na2CO3,可能有KCl
C.步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有Ba(OH)2、Na2CO3、K2SO4
D.步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有3种情况.
查看答案和解析>>
科目:初中化学 来源: 题型:
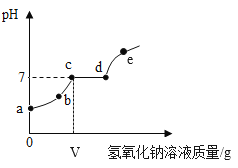
【题目】向一定量的稀盐酸和氯化镁的混合溶液中,逐滴加入一定溶质质量分数的氢氧化钠溶液至过量,溶液pH的变化曲线如图所示:
(1)e点时溶液中含有哪些溶质?_____。
(2)写出cd段发生反应的化学方程式_____。
(3)若将Vg氢氧化钠溶液换用等质量、等溶质质量分数的氢氧化钾溶液,反应后溶液的pH_____7(选填“>”“<”或“=”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图所示实验,Y 烧杯中溶液由红色变为无色。
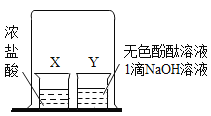
(1)该实验可证明分子具有的性质是__________。
(2)请用化学方程式表示红色变为无色的原因:_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象中,能正确反映对应变化关系的是
A. 向一定量CaCO3中滴加稀盐酸
向一定量CaCO3中滴加稀盐酸
B. 将水通电电解一段时间
将水通电电解一段时间
C. 镁在装有空气的密闭容器中燃烧
镁在装有空气的密闭容器中燃烧
D.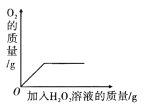 向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液
向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钙应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产氯化钙的流程如下。
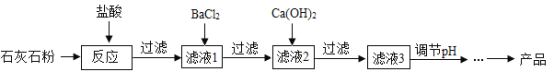
已知:BaCl2+MgSO4=BaSO4↓+MgCl2;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;Ca(OH)2+FeCl3=Fe(OH)3↓+CaCl2
(1)氧化铁与盐酸反应的化学方程式为______________________________。
(2)滤液1中的溶质有HCl、FeCl3、和_______。
(3)滤液2中加入Ca(OH)2是为了除去____(填序号,下同)
A MgCl2 B HClC BaCl2 D FeCl3
(4)为了生产较纯净的氯化钙,滤液3呈碱性,为使溶液pH降低,可加入适量的_____。
A NaCl B NaOHC 硫酸 D 盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具,我们可以从表中获得许多知识。

(1)元素周期表中各周期结尾的元素是___________(填写序号)。
A金属元素 B非金属元素 C稀有气体元素
(2)如图是元素周期表中一个方格内的部分内容,该元素的原子序数是______________,该元素的相对原子质量是___________,写出该元素的单质在空气中受热的化学方程式______________。
(3)把铜片放到硝酸银溶液中,会有银白色固体析出。反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com