
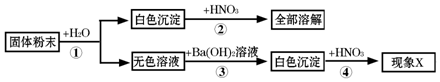
分析 根据硫酸铜在溶液中显蓝色,镁离子和氢氧根离子会生成白色的氢氧化镁沉淀,硫酸根离子和钡离子会生成白色的硫酸钡沉淀,氢氧化镁沉淀会溶于酸,硫酸钡沉淀不会溶于酸等知识,然后依据各物质之间的反应现象和复分解反应发生的条件进行分析解答.
解答 解:硫酸铜在溶液中显蓝色,镁离子和氢氧根离子会生成白色的氢氧化镁沉淀,硫酸根离子和钡离子会生成白色的硫酸钡沉淀,氢氧化镁沉淀会溶于酸,硫酸钡沉淀不会溶于酸.
(1)固体粉末加水溶解后,得到无色溶液,而硫酸铜在溶液中显蓝色,所以固体粉末中一定不含硫酸铜,加水后得到了白色沉淀,而所给的可能物质都易溶于水,所以白色沉淀为物之间反应的生成物,氢氧化钠和氯化镁反应会生成氢氧化镁沉淀,所以固体粉末中一定含有氢氧化钠、氯化镁,所以A中一定含有NaOH、MgCl2,一定不含CuSO4,氢氧化钡和硫酸钠反应会生成硫酸钡沉淀,该沉淀不溶于硝酸,若现象X出现“沉淀不溶解”或“沉淀部分溶解”的情况,说明反应后有硫酸钡生成,所以白色粉末中含有硫酸钠,化学式为:Na2SO4,
(2)使用氢氧化钡溶液能与氯化镁反应生成氢氧化镁沉淀,会对硫酸根离子的检验造成干扰,可以不使用氢氧化钡而使用硝酸钡来检验硫酸根离子,若取消实验④,将③中的试剂换为Ba(NO3)2,也可得出相同结论.
故答案为:(1)Na2SO4;
(2)把第③步使用的Ba(OH)2溶液改为Ba(NO3)2溶液.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物品 | 食用醋 | 洗洁精 | 油污净 | 洁厕灵 |
| pH | 3 | 10 | 13 | 4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
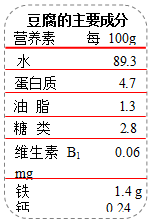 豆腐是生活中常见的食品,主要成分如图所示.
豆腐是生活中常见的食品,主要成分如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com