
ij��ѧ��ȤС��ͬѧ�ڻ��շϾɵ�ص�ͬʱ����չ�����µ�ʵ��̽����
���������ϡ��Ͼɸɵ�����ϵ���Ҫ�ɷ�Ϊ�������̡�̿�ۡ��Ȼ�狀��Ȼ�п�ȣ������Ȼ�李��Ȼ�п������ˮ��
��ʵ��1���ϸɵ�صIJ�ж�봦��
��1����ȤС��ͬѧ���Ͼɸɵ��ж�µ�пͲ��̼����ϴ�ɾ������ã�
��2����ͭñ���������У���ȥ���ۣ���ϴ���ã�
��ʵ��2������ϸɵ��Ͳ�ں�ɫ������MnO2�Ĵ���
��ȤС��ͬѧ�������ͼ��ʾ��ʵ�飺
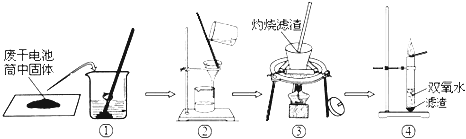
��1�����������������������������
��2�����������պ�ɫ����ʱ�������һ����ʹ����ʯ��ˮ����ǵ����壬������Ϊ������
��3���������Թ��в�����������ʹ������ľ����ȼ��������Ϊ������
��4���ɴ˵ó����ۣ������г����������⣬�����к�ɫ��ĩ������
��ʵ��3�����û���пƤ��ȡ���������̽��
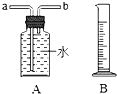
��1����пƤ��ϡ������ȡ���������ʵ��ķ���װ�ã�������ˮ���ռ����ⶨ�������������ͼ���������װ��A���ܿ��������a����b���� ����ѡ������B�����ų�ˮ�����������B������������
��2��̽��Ӱ��п��ϡ���ᷴӦ���������أ���Ӧ��������ǰ10min ��
�ռ�����������ȽϷ�Ӧ�Ŀ�������������������ͬ�������±�4��ʵ�飬������������
| ʵ���� | �Լ�[��Դ��ѧ����ZXXK] | ǰ10 min�ڲ����� ���������mL�� | |
| п�Ĵ��� | ϡ����������Ũ�� | ||
| a | ��п | 30 mL 30% | 564.3 |
| b | �����ʵ�п | 30 mL 30% | 634.7 |
| c | ��п | 30 mL 20% | 449.3 |
| d | ��п | 40 mL 30% | 602.8 |
�����ݷ�����
�ٱȽ�ʵ��a��ʵ��b�õ��Ľ����ǣ�������
��Ϊ���о�����Ũ�ȶԷ�Ӧ������Ӱ�죬��Ƚ�ʵ����������ʵ���ţ���
��̽��Ӱ��÷�Ӧ���������أ�������Ƶ������ǣ���������һ�����ɣ���
��ʵ��4��̽���������ɾ��Ķ�������������طֽⷴӦ�еĴ�����
��1���Ѹ��﴿����24.5g����غ�5.5g�������̻��ȡ�װ����Թ��У����ȣ�
��2������Ӧ��ȫ���Թ���ȴ���������õ�20.4g�������壮
��3���ٽ��������徭�ܽ⡢���ˡ�ϴ�ӡ�����������õ�5.5g��ɫ���壮
�����ݷ�����
�ٸ�ʵ��˵������������������طֽⷴӦǰ���������䣮
����ȫ��Ӧ���Ƶ�����������������g������ʾ����֪���л�ѧ��Ӧ��ѭ���¹��ɣ��μӻ�ѧ��Ӧ�ĸ����ʵ������ܺ͵��ڷ�Ӧ���������������ܺͣ�
��ʵ�鷴˼��
Ҫ֤����������������طֽⷴӦ�Ĵ�������Ҫ��һ���Ա�ʵ�飺����������2������ط�ĩ������һ�ݼ�������������ʵ�����ö������̻��ȡ�װ���Թܣ���һ��װ����һ�Թܣ����ȣ��Ƚ������Ĵ�С��
| ʵ��̽�����ʵ���ɳɷ��Լ�������Ӱ�컯ѧ��Ӧ���ʵ�����̽�������˵�ԭ������������Ӧ�ã��������ص�������ã�̼�Ļ�ѧ���ʣ� | |
| ר�⣺ | ��ѧ̽���� |
| ������ | ��ʵ��2����1�����ݲ����ڷ��������״̬�����˿����������Թ���Ϳ����Թ���ķ�����з����� ��2�����ݡ���ʹ����ʯ��ˮ����ǵ����塱���н�� ��3�����ݡ���ʹ������ľ����ȼ�����н�� ��4�����������к�ɫ��ĩ��MnO2����C�������лش� ��ʵ��3������п����ϡ������ȡ�������ڹ����Һ������ȡ�����Ҳ���Ҫ�����Լ��������ܶȱȿ������ܶ�С���н�� �����ݷ����� ��ͨ������Ƚ�ʵ�����ͬ��Ͳ�ͬ��ó����ۣ� �����ÿ��Ʊ����������Ա����������Ũ�ȣ�������Ƿ�Ӧ�Ŀ������з���ѡ��Ա��飻 �۴�����Ѱ����Ҫ���Ƶ��������¶ȣ�������С�ȣ� �����ݷ����� �ٸ��ݴ������������������з������ڸ��������غ㶨�ɽ��з����� ��ʵ�鷴˼�����Ǵ��������ã� |
| ��� | �⣺������Ŀ�е���Ϣ���Ͼɸɵ�����ϵ���Ҫ�ɷ�Ϊ�������̡�̿�ۡ��Ȼ�狀��Ȼ�п�ȣ������Ȼ�李��Ȼ�п������ˮ�������ͼ��֪�� ��1���������й��������������������� ��2�����������պ�ɫ����ʱ�������һ����ʹ����ʯ��ˮ����ǵ����壬������ΪCO2�� ��3���������Թ��в�����������ʹ������ľ����ȼ��������ΪO2�� ��4���ɴ˵ó����ۣ������г�����MnO2����C���⣬�����к�ɫ��ĩC����MnO2���� ��ʵ��3�����û���пƤ��ȡ���������̽�� ��1����пƤ��ϡ������ȡ��������Ϊ�������ܶ�С�ڿ�����������ˮ�������ʵ��ķ���װ�ã�������ˮ���ռ����ⶨ����������������װ��A���ܿ�b����ѡ������B�����ų�ˮ�����������B������ ��Ͳ�� �����ݷ��������ݱ�����̽��Ӱ��п��ϡ���ᷴӦ���������ص����ݣ����з�����֪�� ��ʵ��a��ʵ��b����ͬ����ͬ���ͬŨ�ȵ�ϡ���ᣬ��ͬ���Ǻ����ʵ�п�ʹ�п����������ʵ�п�ȴ�п��Ӧ����Ҫ�죻 ��Ҫ�о�����Ũ�ȶԷ�Ӧ������Ӱ�죬��Ҫ��ͬŨ�ȵ����ᣬ��Ҫ����п�Ĵ�����ͬ���Ƚϲ��������Ŀ�������˶Ա�����a��c�� �ۿ��Ʊ�������Ҫ���ǵ����Ա���������������������������������ͬ����˿�������������ͬ������Ƶ������磻�¶ȣ���п����״��С���� ��ʵ��4��̽���������ɾ��Ķ�������������طֽⷴӦ�еĴ����� ��1���Ѹ��﴿����24.5g����غ�5.5g�������̻��ȡ�װ����Թ��У����ȣ� ��2������Ӧ��ȫ���Թ���ȴ���������õ�20.4g�������壮 ��3���ٽ��������徭�ܽ⡢���ˡ�ϴ�ӡ�����������õ�5.5g��ɫ���壮 �����ݷ����� �ٸ�ʵ��˵������Ϊ��������Ϊ���������������������طֽⷴӦǰ���������䣮 ����Ϊ�μӻ�ѧ��Ӧ�ĸ����ʵ������ܺ͵��ڷ�Ӧ���������������ܺͣ���ȫ��Ӧ���Ƶ������������ǣ�24.5g+5.5g����20.4g=9.6g�� ��ʵ�鷴˼�� Ҫ֤����������������طֽⷴӦ�Ĵ�������Ҫ��һ���Ա�ʵ�飺����������2������ط�ĩ������һ�ݼ�������������ʵ�����ö������̻��ȡ�װ���Թܣ���һ��װ����һ�Թܣ����ȣ��Ƚϲ����������ʵĴ�С�� �ʴ�Ϊ�� ��ʵ��2����1����������2��CO2����3��O2�� ��4��MnO2����C����C����MnO2���� ��ʵ��3����1��b�� ��Ͳ�� ��2������ͬ���ͬŨ�ȵ�ϡ���ᷴӦ�������ʵ�п�ȴ�п��Ӧ���ʴ�a��c�� ���¶ȣ���п����״��С���� ��ʵ��4��[���ݷ���]�������� ��9.6��[ʵ�鷴˼]������������ |
| ������ | ���⿼���˷ϵ�ص����ʵĻ��ռ��й���������ȡ��̽����֪ʶ��϶࣬���ڻ�ѧʵ�����ʵ�鼼�ܵĿ��飬Ҫ����ƽʱ��ѧϰ��Ҫע�����ճ����Ļ�ѧ��������ԭ�����������ã� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ���ҳ�������װ������ȡ�����ͼ������������ʣ�
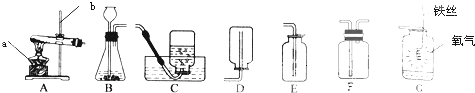
��1��д��ͼ���б�����������ƣ�a������b������
��2���ù���������Һ�Ͷ�����������ȡ����ʱ����ѡ�õķ���װ��������������ţ���������Ӧ�ķ��ű���ʽΪ��������ȡ����ʱ����װ��������Ӧ��������������ҩƷ������Fװ����װ��ˮ�ռ�����������Ӧ������������ҡ�����ͨ�룮���Ҫ���Ʒ�Ӧ���ٶȿ��Խ�����©��������Һ©������
��3��ʵ�����ø��������ȡ����ѡ��װ��A������װ�ã���Ҫ�Ľ��ĵط��������Թܿ���һ���ޡ�����Ӧ�ķ��ű���ʽΪ������������Fװ���ռ��������Ƿ����ķ�����������
��4����ͼG����˿�������о���ȼ�գ���Ӧ�ķ��ű���ʽΪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ڻ�ѧ�仯���ǣ�������
| �� | A�� | �����ܽ� | B�� | ��ˮ�ɱ� | C�� | �������� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ʵ����ʾ������ʵ���;�����ж�Ӧ��ϵ���������ǣ�������
| �� | A�� | ������ѧ���ʲ����ã�������ʳƷ������ |
| �� | B�� | ������̼�ܹ�����ˮ������Ϊ������̼����֧�ֺ��� |
| �� | C�� | þȼ���ܲ���ҫ�۵�ǿ�⣬���������������� |
| �� | D�� | ��������֧��ȼ�գ������ڻ����ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
С��ͬѧ�ռ���һƿ���ǵij���ˮ��������������������ˮ�������Ƴ�����ˮ��
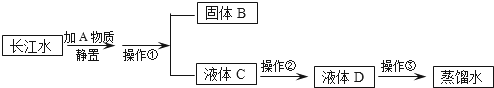
��ش��������⣺
��1��A����������������������ٵ��������������ò�����Ҫ�õ������ֲ����������ձ�����������������
��2��������ѡ��������ȥˮ��ɫ�غ���ζ���ù�����Ҫ�������仯�����������ѧ������
��3��С��ͬѧȡ����Һ��D���Թ��У�����������������������������ĭ���д�����״�������˵��Һ��D��Ӳˮ��ͨ��������������������۵����ƣ����Խ���Ӳˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ�Ҽƻ���������Ϊ20�ĸ����ӣ�����˵����Ϊ98���Ԫ�ذУ�ʹ��Ԫ�ص�ԭ�Ӻ˺ϲ���һ�𣬺ϳɺ˵����Ϊ118����Ԫ�ء��Դ�������ȷ���� �� ��
A����Ԫ�ص�ԭ������Ϊ116 B����Ԫ��ԭ�ӵ�������Ϊ118
C����Ԫ�ص����ԭ������Ϊ118 D���仯������Ԫ������û�з����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪X��Y��Z���ֽ����ܷ������з�Ӧ��
X + H2SO4 == XSO4 + H2��
Y + Z(NO3)2 == Y(NO3)2 + Z
Z + X(NO3)2 == Z(NO3)2 + X
��X��Y��Z���ֽ�������Ļ����ǿ������˳��Ϊ
A��X>H>Y>Z B��Y>Z>X>H
C��Z>Y>X>H D��X>H>Z>Y
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com