解:(1)步骤②是称量一定质量的药品,称取先定砝码(游码)的质量(a g);③是称量未知装置的质量,砝码(游码)试加时先大后小;步骤②和③中添加砝码的方式不同.(2)NaOH溶液、碱石灰均能与二氧化碳反应,均可吸收二氧化碳.
(3)盐酸易挥发,浓H
2SO
4不能与HCl反应,不能除去HCl,HCl被U形管中碱石灰吸收,会造成测定的结果偏高.
(4)“缓缓鼓入”可使空气中的二氧化碳与氢氧化钠充分反应;如果鼓入过快,可能有一部分二氧化碳没有反应就排出去了,从而造成测定结果不准确.
(5)根据题意,实验前称量盛有碱石灰的U型管的质量为bg,至称量所得的质量基本不变为dg,实验前后盛有碱石灰的U型管的质量差(d-b)g即为生成二氧化碳的质量,
设参加反应的碳酸钠的质量为x,
Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
106 44
x (d-b)g
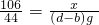
x=
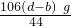
该工业纯碱的纯度为
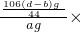
100%=
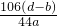
×100%.
(6)根据碳酸钠的化学性质,碳酸钠与Ba(NO
3)
2(BaCl
2)溶液、Ca(NO
3)
2(CaCl
2)溶液反应分别有碳酸钡、碳酸钙沉淀白色生成,氯化钠与AgNO
3、稀HNO
3溶液反应有不溶于酸的氯化银白色沉淀生成,由生成沉淀的质量计算出碳酸钠或氯化钠的质量,进而可计算出该工业纯碱的纯度.
故答案为:(1)添加砝码的方式不同,②中称取先定砝码(游码)的质量(a g),③中称量,砝码(游码)试加时先大后小;
(2)吸收CO
2;
(3)偏高; 盐酸易挥发,浓H
2SO
4不能除不HCl,被U形管中碱石灰吸收;
(4)鼓入空气太快会导致U形管内碱石灰吸收CO
2不完全;
(5)
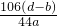
×100%;
(6)A、B、C.
分析:(1)根据用托盘天平称量一定质量的药品和未知装置质量的不同进行分析判断.
(2)根据碱的化学性质进行分析解答.
(3)根据盐酸的物理性质、化学性质对测定的结果的影响进行分析解答.
(4)如果鼓入过快,可能有一部分二氧化碳没有反应就排出去了,从而造成测定结果不准确.
(5)根据题意,纯碱样品的质量为ag,根据碳酸钠与硫酸反应的化学方程式,由生成二氧化碳气体的质量,列式表示出样品中碳酸钠的质量,进而表示出该工业纯碱的纯度即可.
(6)根据碳酸钠、氯化钠的化学性质进行分析判断.
点评:本题难度较大,涉及知识点较多、综合性较强,掌握常见盐的化学性质、酸的性质、常见的干燥剂等并能灵活运用是正确解答本题的关键.

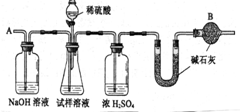 工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.
工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.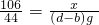 x=
x=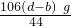
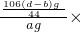 100%=
100%=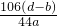 ×100%.
×100%.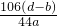 ×100%;
×100%;

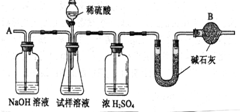 工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.
工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.