
【题目】“见著知微,见微知著”是化学思维的方式。
(1)从微观知宏观
下图所示为元素周期表中部分元素的相关信息,根据要求回答相关问题

①元素与硫元素化学性质相似的原因是____________;
②写出12号和17号元素形成化合物的化学式__________.
(2)从宏观知微观
①木炭在氧气中燃烧比在空气中燃烧更剧烈,结合下图A从微观角度解释其原因_______________________;

②H2SO4溶液能与BaCl2溶液反应产生白色沉淀,其微观变化过程如上图B所示,参加反应的离子是_________(填离子符号)。CuCl2溶液能与NaOH溶液反应产生蓝色沉淀;从反应的微观实质可以推测,CuSO4溶液可以和某溶液反应同时产生两种沉淀,写出该反应的化学方程式___________________.
【答案】 硫原子与氧原子最外层电子数相同 MgCl2 单位体积纯氧中氧分子数目比空气中多,因此纯氧中氧分子与碳原子接触碰撞的机会增多,反应更剧烈 SO42-、Ba2+ Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓
【解析】(1)由于元素的性质主要由最外层的电子数决定的,氧元素与硫元素化学性质相似的原因是:两种原子的最外层电子数相同;
(2)原子序数为12元素为镁元素,原子的最外层有2个电子,小于4,易失去形成镁离子;原子序数为17的元素为氯元素,最外层有7个电子,易得到1个电子形成氯离子,故组成化合物的化学式为MgCl2;
(3)①在纯氧中,单位体积内的氧分子数目更多,与碳原子的碰撞几率更大,反应更剧烈,所以木炭在纯氧中燃烧更剧烈;
②由微观示意图可知,硫酸与氯化钡反应的实质是钡离子和硫酸根离子结合生成了硫酸钡沉淀的缘故;硫酸铜可以与氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,化学方程式为:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓。


科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(原文作者:王龙飞等,有删改)。
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。
生产中大量使用的臭氧通常由以下方法制得。
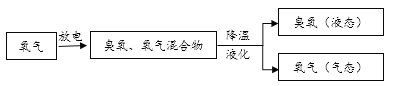
臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表所示。
表 臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2 mg/L) | 二次污染 | 投资成本 (900 m3设备) | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | < 5 min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | > 30 min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题。
(1)臭氧的相对分子质量为_________。
(2)臭氧处理饮用水时,利用了臭氧的_________(填“物理”或“化学”)性质。
(3)臭氧转化为氧气的微观示意图如下,请在方框中补全相应微粒的图示。

![]()
(4)为了快速杀灭病毒,应选择的消毒剂是__________。
(5)下列关于臭氧的说法中,正确的是________。
A.臭氧的漂白作用比氯气强
B.由氧气制得臭氧的过程中,既有物理变化也有化学变化
C.臭氧在生产生活中有很多用途,对人类有益无害
D.臭氧稳定性差,不利于储存,其应用可能会受到限制
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】正常情况下人的胃液pH为0.8—1.5,相应含氯化氢的质量分数为0.2%—0.4%,胃液中氯化氢过多过少都不利于健康。某人出现反胃、吐酸水的症状,经检查其胃液中氯化氢的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_________性。
(2)若人的胃液总量为100mL,正常胃液中HCl的质量范围为___________________ g。
(3)服用碱性物质可以治疗胃液中HCl含量过多,你认为该患者 ___________ (填能或不能)服用熟石灰来治疗胃酸过多,理由是 ______________________________________ 。
(4)医生给患者开的药是胃舒平[有效成分是Al(OH)3],每片胃舒平含Al(OH)3 的质量为0.39g。请根据化学方程式计算该患者至少服用________片胃舒平,胃液才能恢复正常? (请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A-G均为初中化学常见的物质,其中A、B、C、D、E,五种不同类别的物质,A是大理石的主要成分,A、D组成元素不同,F、G组成元素相同且常温下均为液体,它们之间的关系如图所示,(“―”表示相邻两种物质间能发生化学反应;“→”表示两种物质间的转化关系;部分反应物、生成物、反应条件及部分物质间的关系未写出),请回答下列问题:

(1)A的化学式是_________________________________________________;
(2)①反应的化学方程式是__________________________________________;
(3)B的一种用途是________________________________________________;
(4)图中未出现的基本反应类型是_____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过一年的学习,你已经掌握了实验室制取某些气体的方法。请结合下图提供的一些实验装置回答下列问题。
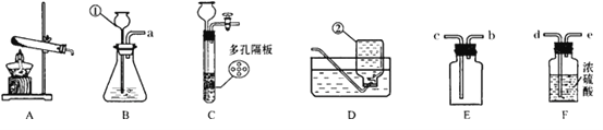
(1)写出图中标有数字的仪器名称:①___________;②_________________。
(2)若用氯酸钾制取氧气,则发生装置应选____,该反应的化学方程式是__________;若用双氧水和二氧化锰制取并收集较纯净的氧气,应选用的装置是_____________ 。
(3)若要制取二氧化碳,在B装置中装有石灰石,那么从仪器①中应加入____________。如果要获得干燥的二氧化碳,还需要用到E、F装置,正确的连接方法是(用导管口代号b、c、d、e表示)a接______,______接______。
(4)实验室如用块状固体和液体无需加热制取气体,可将B装置改进为C装置(多孔隔板用来放置块状固体),其优点是_______________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F是初中化学常见的六种物质,已知A是一种单质,B为红棕色固体,D常用于改良酸性土壤,F与B属于同类物质,其相互反应情况如下图所示(短线“一”相连的物质间能反应,箭头“→”表示能生成)。
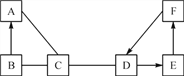
(1)A的化学式为______;A与C的反应属于______反应(填基本反应类型)。F的化学式为______。
(2)写出下列反应或转化的化学方程式:
B与C反应:______________ ;D转化为E:_________。
(3)写出F的一种用途:______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是利用数字化传感器得到的盐酸和氢氧化钠反应过程中溶液pH变化图像。
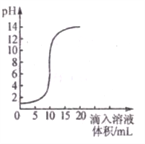
(1)该反应的化学方程式为:_____________________________
(2)根据曲线判断,该反应是将__________________ (填“氢氧化钠溶液”或“盐酸”)滴入另一溶液中。
(3)当滴入溶液的体积为5mL时,所得溶液中的溶质为____________(填化学式),此时烧杯内溶液如果未经处理直接倒入铁制下水道,你认为可能造成的危害是________ (用化学方程式表示)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】宏观和微观相结合是认识物质结构的有效方法之一。
(1)1~18号元素原子最外层电子数与原子序数的关系如下图。X、Y、Z、W表示的元素分别为O、Mg、Al、Cl,试回答下列问题:
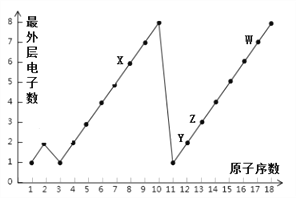
①单质W2与单质Y的反应中,Y原子______ (填“得到“成“失去”)电子,其形成的离子符号为_____________。
②X、Z形成的化合物为______(填物质名称)。
③原子序数分别为2和10的原子最外层电子数不一样,但在元素周期表中都处于同一族,从原子结构上分析其原因:____________
(2)下图为Zn和 NaHSO4溶液反应的微观示意图,回答下列问题:
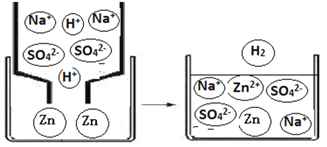
①实际与Zn反应的粒子是____________
②写出烧杯中发生反应的化学方程式:_________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应后试管中的溶液出现分层现象:

【实验现象】
时间 | 观察现象 |
3min | 铝条表面有红色固体出现,铝条所在位置及其上方溶液颜色逐渐变浅,下方溶液没有变化 |
0.5h | 铝条表面聚集大量红色物质,铝条周围溶液呈无色透明,下方溶液仍为蓝色,无色溶液和蓝色溶液界面清晰 |
(1)写出铝和硫酸铜溶液反应的化学方程式___________________。
(2)实验前打磨铝条并将其绕成螺旋状的目的分别是_______________、_______________
(3)根据实验现象判断,铜与铝的金属活动性关系为___________________。
(4)根据反应后明显分层的溶液判断,生成的硫酸铝溶液密度_______(填“>”或“=”或“<”)原硫酸铜溶液密度,根据反应前后物质质量的关系分析,导致这种结果的原因可能是_______________。
附加分:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(5)为促进铝与硫酸铜溶液反应,在配制硫酸铜溶液时加入少量NaCl。
【提出问题】为什么在硫酸铜溶液中加入NaCl,有利于铝与硫酸铜溶液反应?
【提出假设】Cl的存在有利于铝与硫酸铜溶液反应。
【设计实验】请你设计一个合理的实验验证该假设_______________________________。
除以上方案外,你还能想到的另一种方案是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com