
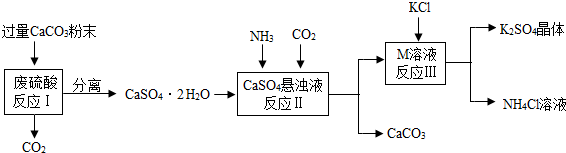
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
 一、K2SO4的制备
一、K2SO4的制备
(1)将CaCO3研成粉末的目的是 ▲ 。
(2)上述流程中可循环使用的物质有CO2和 ▲ (填写化学式)。
(3)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是 ▲ 。
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ▲ ;为检验此晶体是否洗涤干净,可取最后 一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 ▲ 。
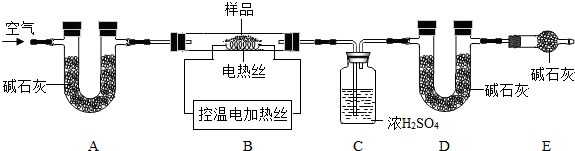
 (6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。

 |
|
①实验前首先要 ▲ ,再装入样品。装置A的作用是 ▲ 。
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g

 某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲  (选填序号)两个数据组合也可求出x:y的值。
(选填序号)两个数据组合也可求出x:y的值。
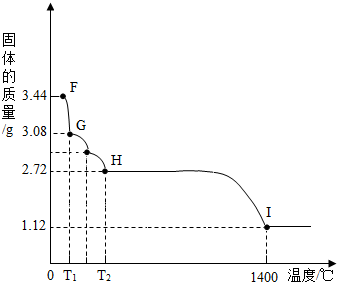
(7)CaSO4•2H2O受热会逐步失去结晶水。取纯
净CaSO4•2H2O固体3.44g,放在(5)的实
验装置B中进行加热,测定固体质量随温
度的变化情况如右图所示。
①G点固体的化学式是 ▲ 。
②将T2~1400℃温度段加热固体所产 生的
生的
气体
|
则H~I段发生反应的化学方程式为 ▲ 。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(江苏镇江卷)化学(解析版) 题型:简答题
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物.
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
|
物质 |
KCl |
K2SO4 |
NH4Cl |
M |
|
溶解度/g(25℃) |
34.0 |
11.1 |
37.2 |
19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4•2H2O加热分解的产物.
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.

①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4•2H2O受热会逐步失去结晶水.取纯净CaSO4•2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(江苏镇江卷)化学(解析版) 题型:简答题
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物.
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
|
物质 |
KCl |
K2SO4 |
NH4Cl |
M |
|
溶解度/g(25℃) |
34.0 |
11.1 |
37.2 |
19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4•2H2O加热分解的产物.
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.

①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4•2H2O受热会逐步失去结晶水.取纯净CaSO4•2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |


查看答案和解析>>
科目:初中化学 来源:2013年江苏省镇江市中考化学试卷(解析版) 题型:填空题

| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com