
下列有关硫酸的叙述中不正确的是( )
A.硫酸溶液中K+、Ca2+、OH﹣、Cl﹣可以大量共存
B.硫酸和盐酸溶液中都含有H+,因此它们的化学性质相似
C.在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌
D.稀硫酸滴加到氢氧化钡溶液中,出现白色沉淀,即可说明中和反应已经发生
科目:初中化学 来源:2017届广东省毕业生学业考试模拟化学试卷(解析版) 题型:简答题
为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11g样品及足量的水配成溶液;②向三个烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到wg的白色固体.实验数据如下:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入CaCl2的质量/g | 5.55 | 12 | 15 |
W/g | 5 | 10 | 10 |
回答下列问题:
(1)将烧杯Ⅲ中的溶液蒸干,得到 g固体,该固体由 和 组成(只填化学式).
(2)样品中碳酸钠的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源:2017届江苏省九年级3月月考化学试卷(解析版) 题型:选择填充题
下列各组变化中,每一转化在一定条件下均能一步实现的是
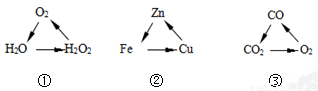
A. ①② B. 只有③ C. ②③ D. ①②③
查看答案和解析>>
科目:初中化学 来源:2017届江苏省苏州市九年级中考复习基础练习9《酸的性质》化学试卷(解析版) 题型:信息分析题
归纳总结是学习化学的重要方法,某化学兴趣小组学习碱的性质后,通过实验对氢氧化钙的化学性质进行了验证和总结,如图所示“﹣﹣”表示物质两两之间能发生化学反应.请根据如图,回答问题.(已知:CaCl2溶液呈中性,CaCl2+Na2CO3═CaCO3↓+2NaCl)
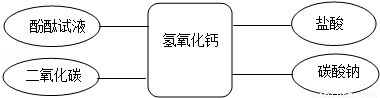
(1)甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈__(填“酸性”、“碱性”或“中性”);
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到的现象是__,此时所得溶液中含有的溶质有__(酸碱指示剂除外);
(3)丙同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是__(酸碱指示剂除外),可能含有的溶质是__;为验证可能含有的溶质,请写出实验操作过程及现象__.
查看答案和解析>>
科目:初中化学 来源:2017届江苏省苏州市九年级中考复习基础练习9《酸的性质》化学试卷(解析版) 题型:选择填充题
在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持一起已略去),引起同学们的兴趣.如图是四位同学对实验中的部分现象进行的预测,预测正确的是( )
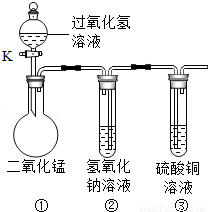
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:初中化学 来源:2017届江苏省苏州市九年级中考复习基础练习9《酸的性质》化学试卷(解析版) 题型:选择填充题
向稀盐酸中加入Z物质,其pH变化情况如图所示,则Z物质是( )

A. H2O B. AgNO3固体 C. 浓盐酸 D. KOH固体
查看答案和解析>>
科目:初中化学 来源:2017届江苏省苏州市九年级中考复习基础练习9《酸的性质》化学试卷(解析版) 题型:选择题
某同学错题本中记录的下列内容,不合理的是( )
A.盐酸用于金属表面除锈
B.金刚石可用来割玻璃
C.熟石灰常用作食品干燥剂
D.干冰用于人工降雨
查看答案和解析>>
科目:初中化学 来源:2017届贵州省黔西南州望谟县乡镇九年级上学期期末联考化学试卷(解析版) 题型:信息分析题
用有关化学用语符号填空。
(1)干冰________,
(2)某气体在空气中占78%(体积百分含量),是_______,
(3)地壳中含量最多的金属元素形成的离子______,
(4)标出氧化铁中铁元素的化合价___________。
查看答案和解析>>
科目:初中化学 来源:2017届江苏省无锡江阴市要塞片九年级第一次模拟考试化学试卷(解析版) 题型:探究题
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。某兴趣小组同学对其进行探究。
一、过氧化钙的性质研究
(1)取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试
管中,观察到带火星的木条 ,说明过氧化钙与水反应有氧气生成。
(2)分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈 性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成。
结论:过氧化钙和水反应生成氢氧化钙和氧气。
二、过氧化钙的制备研究
实验室用钙盐制备CaO2,其主要实验装置(图1)和流程(图2)如下:
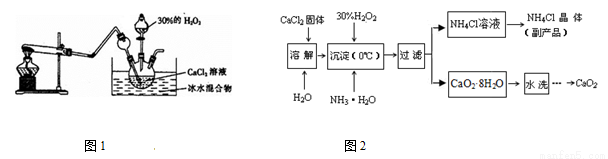
(3)图1试管中的物质是NH4Cl和Ca(OH)2,加热时发生反应生成CaCl2、NH3 和H2O,
反应的化学方程式为 。
(4)“沉淀”时发生的反应为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,需
要控制温度在0℃左右,采用的操作是将反应容器放置在 中,反应温度不能过高
的原因是:①防止氨水挥发;② 。
(5)“过滤”所得的副产品NH4Cl可做化肥中的 肥。检验“水洗”已经洗净的方
法是:取最后一次洗涤液少量于试管中, 。
(6)加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2  2CaO+O2↑)。
2CaO+O2↑)。
右图是实验室测定产品中CaO2纯度的装置。实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算。(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程)。
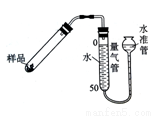
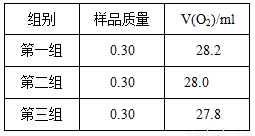
若样品质量用wg表示,反应前称量药品和小试管总质量为mg,反应后在空气中冷却,称量药品和小试管总质量为ng,则CaO2纯度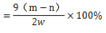 ,此方案测定结果偏小的原因可能是 。
,此方案测定结果偏小的原因可能是 。
[
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com