
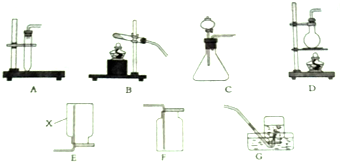
 实验室部分装置如图所示,请回答下列问题.
实验室部分装置如图所示,请回答下列问题.分析 集气瓶是收集气体的仪器,制取装置包括加热和不需加热两种,实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,分液漏斗方便加液体药品或控制反应的速率.若实验室通过加热亚硝酸钠和氯化铵的混合溶液制取并收集N2时,应该选择的发生装置是D,氮气难溶于水,可以用排水法收集,N2的密度与空气的密度几乎相等,一般不用排空气法收集.
解答 解:(1)集气瓶是收集气体的仪器,故答案为:集气瓶;
(2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,分液漏斗方便加液体药品或控制反应的速率;故答案为:A或C;F;C;F;
(3)若实验室通过加热亚硝酸钠和氯化铵的混合溶液制取并收集N2时,应该选择的发生装置是D,氮气难溶于水,可以用排水法收集,N2的密度与空气的密度几乎相等,一般不用排空气法收集;故答案为:DG;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了装置的优点等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


科目:初中化学 来源: 题型:选择题
| A. | CO2 | B. | SO2 | C. | CO | D. | NO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
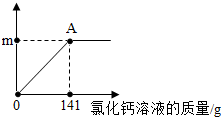 家里蒸馒头的纯碱中含有少量的氯化钠.为测定该纯碱中碳酸钠的质量分数:取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g.(反应方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl)计算:
家里蒸馒头的纯碱中含有少量的氯化钠.为测定该纯碱中碳酸钠的质量分数:取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g.(反应方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl)计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
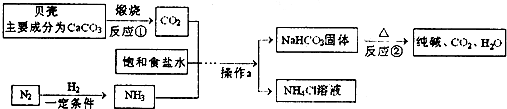
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,滴加稀盐酸 | 产生无色无味气体 | 说明滤液中含有的物质是NaHCO3 |
| ②另取少量滤液于试管中,滴加足量稀HNO3后,再滴加AgNO3溶液 | 产生白色沉淀 | 证明滤液中含有NaCl |
| 第一组 | 第二组 | 第三组 | 第四组 | |
| CaCl2溶液的质量(克) | 100 | 200 | 300 | 400 |
| 产生沉淀的质量(克) | 8 | 16 | 20 | 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com