解:(1)图中a是锥形瓶,b是分液漏斗,c是导管,d是水槽.
故答案为:锥形瓶;分液漏斗;导管;水槽.
(2)b是分液漏斗,可以通过控制开关来控制液体的滴加,从而控制反应的进行;检查装置的气密性时,在导管上接乳胶管并用弹簧夹夹紧,向分液漏斗内不断加水,一段时间后分液漏斗内液面不在下降,则气密性良好.
故答案为:反应随开随关;在导管上接乳胶管并用弹簧夹夹紧,向分液漏斗内不断加水,一段时间后分液漏斗内液面不在下降,则气密性良好.
(3)用双氧水和二氧化锰来制取氧气时,是固体和液体的不加热反应,所以用B作为发生装置;反应的符号表达式为:2H
2O
2
2H
2O+O
2↑;其中二氧化锰是催化剂.
故答案为:B;2H
2O
2
2H
2O+O
2↑;催化剂.
(4)用高锰酸钾来制备氧气,是固体的加热反应,所以用装置A作为发生装置;该反应的符号表达式为:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;此反应中二氧化锰是作为生成物;排空气法可以收集到干燥的氧气,因为氧气的密度大于空气的密度,所以用向上排空气法.
故答案为:A;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;生成物;D.
(5)用双氧水和二氧化锰来制取氧气不需加热,操作简便.
故答案为:用双氧水和二氧化锰来制取氧气;不需加热,操作简便.
(6)①用不同质量分数的H
2O
2溶液,反应条件分无催化剂不加热、无催化剂加热、有催化剂并且加热,说明考虑了温度、催化剂对过氧化氢分解速率的影响.
故答案为:温度;催化剂
②在无催化剂不加热条件下不分解,而在无催化剂加热条件下的分解,说明温度对过氧化氢分解速率的影响.
故答案为:温度越高,过氧化氢的分解速率越快(或过氧化氢浓度越高,过氧化氢的分解速率越快或使用催化剂,过氧化氢的分解速率越快)
分析:(1)熟悉常见仪器,了解名称;
(2)b是分液漏斗,可以通过控制开关来控制液体的滴加,从而控制反应的进行;密性主要根据内外气压来检测的,瓶内的气压大于外界气压时,插到水中的导气管应该有气泡冒出.
(3)用双氧水和二氧化锰来制取氧气时,是固体和液体的不加热反应,据此选择实验的发生装置;根据反应物、反应条件、生成物写出化学反应式;其中二氧化锰是催化剂.
(4)用高锰酸钾来制备氧气,是固体的加热反应,据此选择发生装置;根据根据反应物、反应条件、生成物写出化学反应式;其中二氧化锰是生成物;排空气法可以收集到干燥的氧气.
(5)根据反应的条件和生成物分析.
(6)本题对影响过氧化氢(H
2O
2)分解速率的因素进行探究,首先用不同溶质质量分数的H
2O
2溶液,在无催化剂不加热条件下分解情况时;其次无催化剂加热条件下的分解情况;再次是加入MnO
2并且加热条件下的分解情况,根据实验数据很容易找到规律.
点评:实验室制取氧气的实验是初中化学的重点内容,对于实验装置的选择、化学方程式的书写、注意事项等内容,同学们一定要了然于心.
同时(6)题是基础的延伸,通过对比实验结果的分析,找到事物的内在联系,是考查学生的分析问题的能力,同时也是对“影响反应速率因素”这一知识点进行了较深入的分析.


 2H2O+O2↑;其中二氧化锰是催化剂.
2H2O+O2↑;其中二氧化锰是催化剂. 2H2O+O2↑;催化剂.
2H2O+O2↑;催化剂. K2MnO4+MnO2+O2↑;此反应中二氧化锰是作为生成物;排空气法可以收集到干燥的氧气,因为氧气的密度大于空气的密度,所以用向上排空气法.
K2MnO4+MnO2+O2↑;此反应中二氧化锰是作为生成物;排空气法可以收集到干燥的氧气,因为氧气的密度大于空气的密度,所以用向上排空气法. K2MnO4+MnO2+O2↑;生成物;D.
K2MnO4+MnO2+O2↑;生成物;D.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
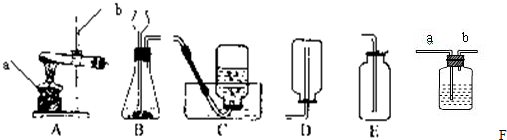

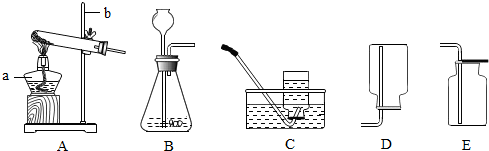
 实验室常用下列装置来制取氧气:
实验室常用下列装置来制取氧气: