
【题目】(6分)下图表示初中常见几种不同物质之间的关系,图中“……”表示虚线两边的物质可以转化或相互反应,A、B、C、D的相对分子质量依次增大。请根据以下每个问题的具体情况分别进行回答。
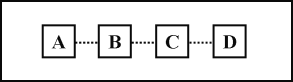
(1)若A能依次转化为D,A为标准状态下密度最小的气体,D的相对分子质量为100。则A的化学式为 ,C的化学式为 。
(2)若从A到D,相邻物质间可以互相反应,且A、B、C、D为四种不同类别的物质,C固体在空气中易潮解且溶于水会放热,则A与B反应的化学方程式为 ,判断B和C是否恰好完全反应,加入的试剂是 。
(3)若D能依次转化为A,D由三种元素组成,原子个数比为1:2:2,则B的化学式为 ,D→C的化学反应方程式为 。
【答案】(1)H2 Ca(OH)2
(2)Mg + 2HCl ===MgCl2 + H2↑ 或 2Al + 6HCl === 2AlCl3 + 3H2↑ 紫色石蕊试剂
(3)H2O Na2CO3 + Ca(OH)2 CaCO3↓+ 2NaOH
【解析】
试题分析:(1) A为标准状态下密度最小的气体,为氢气,D的相对分子质量为100,则为碳酸钙CaCO3,因为A能依次转化为D,则B为水,C为Ca(OH)2,A的化学式:H2,C的化学式为:Ca(OH)2
(2) C固体在空气中易潮解且溶于水会放热,可判断为NaOH,根据碱的化学性质,B可能为二氧化碳,但由于A、B、C、D的相对分子质量依次增大,NaOH相对分子质量为40,二氧化碳相对分子质量为44,所以不可能,那么B就只能是酸,并且只能是盐酸,则A 只能为活泼金属Mg或Al,所以则A与B反应的化学方程式为:Mg + 2HCl ===MgCl2 + H2↑ 或 2Al + 6HCl === 2AlCl3 + 3H2↑,要判断B和C是否恰好完全反应,加入的试剂是:紫色石蕊试剂
(3) D能依次转化为A,D由三种元素组成,原子个数比为1:2:2,抓住常见的物质,只有Ca(OH)2符合,结合A、B、C、D的相对分子质量依次增大,所以可推断C为NaOH,B为水,A为氢气,故则B的化学式为H2O,D→C的化学反应方程式为:Na2CO3 + Ca(OH)2 CaCO3↓+ 2NaOH


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】(9分)用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如下:

请回答下列问题:
(1)产品K2FeO4中Fe的化合价是 ;
(2)固体B的成分是 ,溶液C一定含有的溶质是 ;
(3)操作I的名称是 ,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需 ,请说出该仪器的另外一种用途 。
(4)请写出有关反应的化学方程式,并回答问题:
反应① ,属于 (填基本反应类型);
反应③中沉淀D与H2O2发生化合反应,反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化合物由碳、氢两种元素组成,这两种元素的质量比为6:1,已知该化合物的化学式量为28,则其化学式为( )
A. CH4 B. C2H2 C. C2H4 D. C2H6
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有X、Y、Z三种金属,将Y、Z放入X的盐溶液中,发现Y、Z上均有X析出,再将X、Z放入Y的盐溶液中,发现X、Z上均没有Y析出,则三种金属的活泼性顺序为
A.X、Y、Z B.Z、Y、X C.Y、X、Z D.Y、Z、X
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于氧气制取和性质的叙述中,不正确的是( )
A. 实验室制取氧气时,应先加入药品,再检查装置的气密性
B. 在此反应前后,二氧化锰的质量和化学性质都不发生改变
C. 铁丝在纯氧中剧烈燃烧时,火星四射,生成黑色固体
D. 氧气是一种化学性质比较活泼的气体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常见的下列现象,都属于化学变化的一组是( )
A.酒精燃烧,汽油挥发,蜡烛变形
B.植物腐烂,钢铁生锈,牛奶变质
C.绿色植物的光合作用,铁铸成钢,蜡烛加热熔化
D.葡萄酿酒,水分蒸发,金属导电
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了探究实验室中久置的生石灰样品变质情况,同学们进行如下图所示的实验。下列分析和结论不正确的是
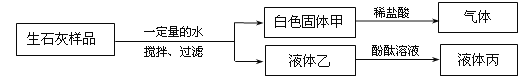
A.该样品已完全变质
B.液体丙呈红色或无色
C.该样品中一定含有碳酸钙
D.白色固体甲可能为Ca(OH)2和CaCO3的混合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验现象的描述中,正确的是
A. 硫在氧气中燃烧发出淡蓝色火焰
B. 铁丝在氧气中剧烈燃烧火星四射,生成四氧化三铁
C. 红磷在空气中燃烧产生大量白雾
D. 木炭在氧气中燃烧发出白光
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(11分)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
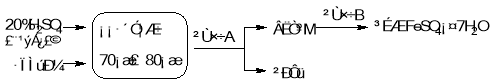
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有: ; 。
(2)滤液M中肯定含有的溶质的化学式是 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和 ;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
根据溶解度表,硫酸亚铁晶体(FeSO4·7H2O)冷却结晶温度最高不超过 ℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应。下列反应类型肯定是氧化还原反应的是 (填字母编号);
A.化合反应B.置换反应C.分解反应D.复分解反应
氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等。
将无水硫酸亚铁(FeSO4)隔绝空气加强热,分解产物有三氧化二铁和另两种氧化物,试写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com