
| ||
| ||


 天天练口算系列答案
天天练口算系列答案科目:初中化学 来源: 题型:
 如图为元素周期表中钠元素的相关信息,下列说法不正确的是( )
如图为元素周期表中钠元素的相关信息,下列说法不正确的是( )| A、钠元素符号为Na |
| B、钠为金属元素 |
| C、钠原子的实际质量为22.99 g |
D、钠离子结构示意图为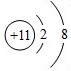 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 城市 | 广州 | 深圳 | 佛山 | 河源 | 肇庆 | 东莞 | 中山 |
| 2008年雨水平均pH | 4.47 | 4.8 | 4.54 | 6.37 | 4.86 | 4.83 | 4.58 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.
如图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:

| A、t1℃时,甲和乙溶解度均为30g |
| B、t2℃时,甲和乙的饱和溶液中溶质质量分数相等 |
| C、t2℃时,在100g水中放入60g甲,其溶质的质量分数为37.5% |
| D、t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 在化肥尿素[CO(NH2)2]中,试计算:
在化肥尿素[CO(NH2)2]中,试计算:查看答案和解析>>
科目:初中化学 来源: 题型:
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 固体剩余物中的MnO2对H2O2分解有催化作用 |
| 2 | 取0.2gMnO2加入5mL |
平稳反应,放出热量,持续产生气体 | MnO2对H2O2分解有催化作用 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | 固体剩余物中无 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 加碘食盐相关信息如图所示.
加碘食盐相关信息如图所示.| 产品标准号: | GB5461-2000 |
| 质量等级: | 二级 |
| 碘含量: | 35±15(20-50)mg/kg |
| 配料: | 食盐、碘酸钾 |
| 储存方法: | 防潮、放热、避光 |
| 分装日期: | 年/月 |
| 保质期: | 十二个月 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com