
| 次 数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀硫酸质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体质量/g | 26.75 | 23.5 | 20.25 | 17 | 16.5 |
分析 (1)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3;
(2)根据铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜解答;
(3)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写;再根据反应特征确定反应类型.
(4)Al与四氧化三铁发生铝热反应生成氧化铝与Fe;
(5)根据实验室制取氢气的反应物是固体和液体,反应条件是常温,排水法收集的气体纯净,排空气法收集的气体干燥,氢气密度比空气小,锌和硫酸反应生成硫酸锌和氢气进行分析;据实验室用过氧化氢制取氧气的反应物是固体和液体,反应条件是常温解答;
(6)根据金属镁的质量求出稀硫酸的溶质的质量即可求出所加稀硫酸的溶质的质量分数进行解答.
解答 解:
(1)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为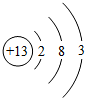 ;
;
(2)通常情况下铝制品很耐腐蚀,这是因为铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化.
(3)Al与NaOH溶液反应生成H2和NaAlO2,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)Al与四氧化三铁发生铝热反应生成氧化铝与Fe,反应方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
(5)实验室制取氢气的反应物是固体和液体,反应条件是常温,排水法收集的气体纯净,排空气法收集的气体干燥,浓硫酸进行干燥;氢气密度比空气小,所以应选用的装置组合是BFE;采取常温下二氧化锰催化分解过氧化氢溶液的方法,生成的氧气不易溶于不、密度大于空气;(或使用石灰石与稀盐酸反应,生成气体二氧化碳能溶于水);反应的化学方程式为2HCl+CaCO3═CaCl2+H2O+CO2↑(或2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑).
检验B装置的气密性的方法是:先从长颈漏斗中注入水,当水浸没其下端管口时,用止水夹夹住导气管上连接的胶皮管,保证此处不漏气;然后再加入少量的水,若停止加水后,长颈漏斗中的水面不再下降,则说明此装置气密性良好;
(6)与20g稀硫酸完全反应消耗锌的质量为:30g-26.75g=3.25g,
设与3.25g锌反应的硫酸的质量为x,
Zn+H2SO4=ZnSO4+H2↑,
65 98
3.25g x
$\frac{65}{3.25g}=\frac{98}{x}$
x=4.9g,
硫酸中溶质的质量分数为:$\frac{4.9g}{20g}×$100%=24.5%
答案:
(1)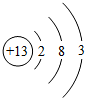 ;
;
(2)铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化;
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
(5)AFE;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;先从长颈漏斗中注入水,当水浸没其下端管口时,用止水夹夹住导气管上连接的胶皮管,保证此处不漏气;然后再加入少量的水,若停止加水后,长颈漏斗中的水面不再下降,则说明此装置气密性良好;
(6)稀硫酸中溶质的质量分数为24.5%.
点评 本题主要考查了化学方程式的书写方法及其铝的性质和用途等方面的知识,可以依据已有的知识进行.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 属于氧化物 | |
| B. | 由两个金属元素和一个非金属元素组成 | |
| C. | 铁元素化合价为+6 | |
| D. | 其中钠、铁、氧元素质量比是2:1:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KNO3 Na2CO3 KOH | B. | Na2SO4 FeCl3 NaCl | ||
| C. | HCl K2SO4 AgNO3 | D. | BaCl2 NH4Cl ZnSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. |  将质量相等且足量的锌粉和铁粉,分别投入相同质量、相同溶质质量分数的稀盐酸中 | |
| B. |  将一种稀硫酸均分成两份,分别向其中投入足量的氧化锌和碳酸锌 | |
| C. |  逐滴向一定量的氢氧化钠溶液中滴加稀盐酸直至过量 | |
| D. |  不断向稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是炼铁的模拟实验示意图,该反应的化学方程式Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,下列有关说法错误的是( )
如图是炼铁的模拟实验示意图,该反应的化学方程式Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,下列有关说法错误的是( )| A. | 该实验可以观察到红色粉末变黑 | |
| B. | 待氧化铁完全反应,先停止通一氧化碳,后停止加热 | |
| C. | 氧化铁与一氧化碳的反应须在没有氧气的环境中进行 | |
| D. | 放置点燃的酒精灯目的是消除一氧化碳对环境的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com