
 ×100%,溶液样品中氢氧化钠分别与硫酸和硫酸铜发生反应,与硫酸铜发生反应的氢氧化钠可根据反应的化学方程式由生成蓝色沉淀4.3g而求得;而与硫酸反应的氢氧化钠的需要根据该反应的化学方程式由生成硫酸钠的质量进行计算,其中硫酸钠的质量需通过所得质量分数为10%的无色溶液中硫酸钠的质量与生成蓝色沉淀时生成的硫酸钠的质量差求出,因此为了计算质量分数为10%的无色溶液中硫酸钠的质量,还需要求计算10%的溶液的质量,该溶液的质量则可利用质量守恒定律求出.
×100%,溶液样品中氢氧化钠分别与硫酸和硫酸铜发生反应,与硫酸铜发生反应的氢氧化钠可根据反应的化学方程式由生成蓝色沉淀4.3g而求得;而与硫酸反应的氢氧化钠的需要根据该反应的化学方程式由生成硫酸钠的质量进行计算,其中硫酸钠的质量需通过所得质量分数为10%的无色溶液中硫酸钠的质量与生成蓝色沉淀时生成的硫酸钠的质量差求出,因此为了计算质量分数为10%的无色溶液中硫酸钠的质量,还需要求计算10%的溶液的质量,该溶液的质量则可利用质量守恒定律求出.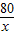 =
=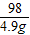 x=4g
x=4g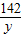 =
=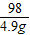 y=7.1g
y=7.1g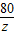 =
=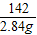 z=1.6g
z=1.6g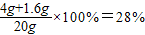


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 浓硫酸是重要的化工原料.试回答:
浓硫酸是重要的化工原料.试回答:查看答案和解析>>
科目:初中化学 来源: 题型:
 为测定某氢氧化钠溶液中NaOH的质量分数,小江同学用7.3%的稀盐酸与20g待测氢氧化钠溶液反应,并绘制溶液pH随加入稀盐酸质量变化的图象(如图).
为测定某氢氧化钠溶液中NaOH的质量分数,小江同学用7.3%的稀盐酸与20g待测氢氧化钠溶液反应,并绘制溶液pH随加入稀盐酸质量变化的图象(如图).查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省泰州市永安初级中学九年级(下)月考化学试卷(3月份)(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2011-2012学年浙江省绍兴市浣纱中学九年级(下)月考化学试卷(3月份)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com