
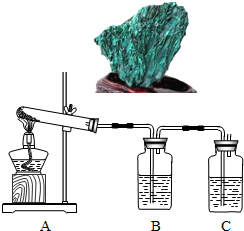
 孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理. 2CuO+CO2↑+H2O 2CuO+C
2CuO+CO2↑+H2O 2CuO+C 2Cu+CO2↑
2Cu+CO2↑| 实验操作及现象 | 实验结论 |
| 该黑色粉末为氧化铜 |
| 配方l | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
 2CuO+CO2↑+H2O,碱式碳酸铜[Cu2(OH)2CO3]为绿色,CuO为黑色固体;所以加热分解碱式碳酸铜A中固体的变化是绿色固体变黑;
2CuO+CO2↑+H2O,碱式碳酸铜[Cu2(OH)2CO3]为绿色,CuO为黑色固体;所以加热分解碱式碳酸铜A中固体的变化是绿色固体变黑; 2CuO+CO2↑+H2O,碱式碳酸铜[Cu2(OH)2CO3]为绿色,CuO为黑色固体进行回答;
2CuO+CO2↑+H2O,碱式碳酸铜[Cu2(OH)2CO3]为绿色,CuO为黑色固体进行回答;

科目:初中化学 来源: 题型:阅读理解
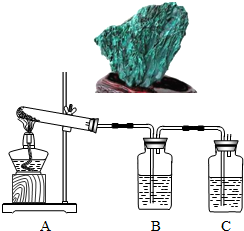 (2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
(2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
| ||
| ||
| 实验操作及现象 | 实验结论 |
| 该黑色粉末为氧化铜 |
| 配方l | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
查看答案和解析>>
科目:初中化学 来源:2012届北京市大兴区中考二模化学试卷(带解析) 题型:探究题
(7分)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料。某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理。
【查阅资料】
1.Cu2(OH)2CO3  2CuO+CO2 + H2O
2CuO+CO2 + H2O
2CuO+C 2Cu + CO2 ↑
2Cu + CO2 ↑
2.CuO为黑色固体,化学性质和氧化铁相似。
(1)实验l:加热分解碱式碳酸铜。装置如图所示。
①A中固体的变化为____。
②欲证明反应后有水生成,B中所盛试剂为____。
③反应结束时的操作应该是____,理由是____。
(2)实验2:木炭和氧化铜反应。
将木炭粉末和氧化铜粉末混合均匀,放进试管加热,反应后将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余。该小组同学设计方案验证黑色粉末的成分。
【作出猜想】
剩余黑色粉末可能是:①氧化铜;②木炭;③木炭和氧化铜。
【实验验证】填写下表。
| 实验操作及现象 | 实验结论 |
| | 该黑色粉末为氧化铜 |
| | 配方l | 配方2 | 配方3 | 配方4 |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
查看答案和解析>>
科目:初中化学 来源:大兴区二模 题型:问答题
| ||
| ||
| 实验操作及现象 | 实验结论 |
| 该黑色粉末为氧化铜 |
| 配方l | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |

查看答案和解析>>
科目:初中化学 来源:2012年北京市大兴区中考化学二模试卷(解析版) 题型:填空题
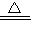 2CuO+CO2↑+H2O 2CuO+C
2CuO+CO2↑+H2O 2CuO+C 2Cu+CO2↑
2Cu+CO2↑| 实验操作及现象 | 实验结论 |
| 该黑色粉末为氧化铜 |
| 配方l | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com