
| A. | 硝酸镁-MgNO3 | B. | 2个钾离子-2K+ | C. | 3个氧原子-O3 | D. | 氧化铝-AlO |
分析 A、硝酸镁中镁元素显+2价,硝酸根显-1价,据此进行分析判断.
B、离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
C、原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
D、氧化铝中铝元素显+3价,氧元素显-2价,据此进行分析判断.
解答 解:A、硝酸镁中镁元素显+2价,硝酸根显-1价,其化学式为:Mg(NO3)2,故选项化学用语书写错误.
B、由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故2个钾离子可表示为:2K+,故选项化学用语书写正确.
C、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故3个氧原子表示为:3O,故选项化学用语书写错误.
D、氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3,故选项化学用语书写错误.
故选:B.
点评 本题难度不大,掌握常见化学用语(原子符号、化学式、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:初中化学 来源: 题型:多选题
| A. | 实验证明氢氧化钠是否变质,加入一滴稀盐酸,没有观察到气泡说明没有变质 | |
| B. | 鸡蛋清加入某盐溶液,有固体析出,蛋白质不一定变性 | |
| C. | 高炉炼铁中所需的高温和一氧化碳的生成都与焦炭有关 | |
| D. | 某化肥中加熟石灰研磨,未闻到氨臭味,该化肥一定不是氮肥 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
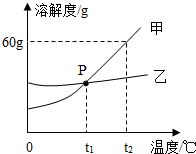 海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.
海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 试剂 | 操作 |
| A | Fe | Fe2O3 | 盐酸 | 结晶 |
| B | NH4HCO3 | NaCl | - | 加热 |
| C | Cu(NO3)2溶液 | BaCl2 | AgNO3溶液 | 过滤 |
| D | O2 | 水蒸气 | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 钠离子-$\stackrel{+1}{Na}$ | B. | 2个氢分子-2H | ||
| C. | 3个酒精分子-3C2H5OH | D. | 3个氧原子-O3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
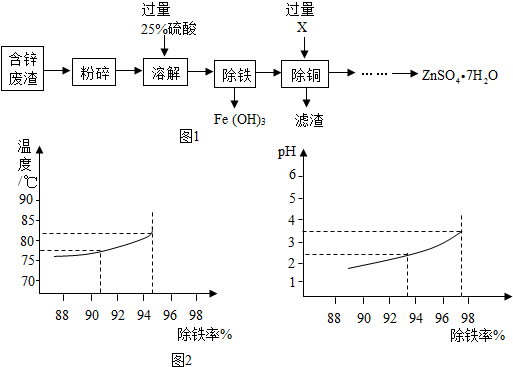
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com