
【题目】如图是实验室常用的部分实验装置,请按要求回答问题。
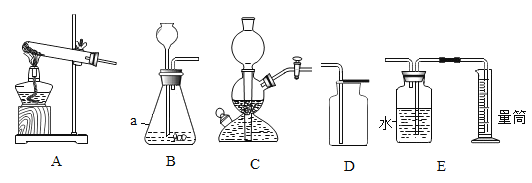
①图中仪器a的名称是________。
②实验室用氯酸钾和二氧化锰混合制取O2,反应的化学方程式为_________;其中二氧化锰固体的颜色是_______。
③实验室用大理石和稀盐酸制取一瓶CO2,发生装置选择_____(填“A”或“B”);用D装置收集二氧化碳,检验集满的方法是____________。
④实验室用稀硫酸和锌粒反应制取氢气,可选择C作为发生装置,理由是_________;E装置可用来测量生成氢气的体积,进行操作时,集气瓶未装满水是否会影响实验结果______(填“是”或“否”)。
⑤计算制取0.5 mol氢气至少需要多少克锌粒与稀硫酸反应?_______。(根据化学方程式列式计算)
【答案】锥形瓶 2KClO3![]() 2KCl+3O2↑ 黑色 B 用燃着的木条放在集气瓶口,火焰熄灭则满 块状(或大颗粒状)固体和液体,不需加热的反应 否 32.5g
2KCl+3O2↑ 黑色 B 用燃着的木条放在集气瓶口,火焰熄灭则满 块状(或大颗粒状)固体和液体,不需加热的反应 否 32.5g
【解析】
①图中仪器a的名称是锥形瓶;
②实验室用氯酸钾和二氧化锰混合制取O2,反应原理是氯酸钾在二氧化锰的作用下受热分解,生成氯化钾和氧气,化学方程式为2KClO3![]() 2KCl+3O2↑;其中二氧化锰固体的颜色是黑色;
2KCl+3O2↑;其中二氧化锰固体的颜色是黑色;
③实验室用大理石和稀盐酸制取一瓶CO2,反应物是固体和液体,条件是常温,发生装置选择B;用D装置收集二氧化碳,检验集满的方法是用燃着的木条放在集气瓶口,火焰熄灭则满;
④实验室用稀硫酸和锌粒反应制取氢气,可选择C作为发生装置,理由是块状(或大颗粒状)固体和液体,不需加热的反应;E装置可用来测量生成氢气的体积,进行操作时,集气瓶未装满水不会影响实验结果,因压入量筒内水的体积等于实验中进入集气瓶内气体的体积;
⑤设制取0.5 mol氢气至少需要物质的量为x的锌粒与稀硫酸反应,
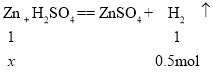
![]()
x = 0.5 mol
Zn的质量为:0.5mol×65g/mol=32.5g


科目:初中化学 来源: 题型:
【题目】酒精(C2H6O)、硫酸铜、甲醛(CH2O)、过氧乙酸(C2H4O3)、次氯酸钠( NaClO)都是生产和生活中常用的消毒剂。
(1)上文所述杀菌消毒剂中属于有机物的有________种。
(2)次氯酸钠( NaClO中氯元素的化合价是___________。
(3)生活中常用酒精(C2H6O)杀菌消毒,其原理是________________
(4)过氧乙酸分子中含有一种叫“过氧基”的结构(—O—O—),据此推测下列物质也可作杀菌消毒剂的是________。
A H-O-H B O=C=O C  D H-O-O-H
D H-O-O-H
(5)工业上用低品位的氧化铜矿加稀硫酸浸渍,然后进行浓缩,可以制取硫酸铜。写出上述过程中生成硫酸铜的化学方程式___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“宏观一微观”之间建立联系,是化学学科特有的思维方式。下图是某反应的微观示意图,下列有关该反应说法错误的是
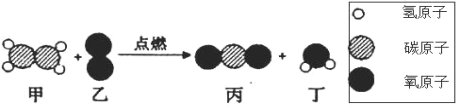
A. 反应前后原子个数不变B. 属于复分解反应
C. 生成的丙和丁的质量比为 22:9D. 反应前后分子个数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
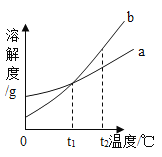
A.b的溶解度大于a的溶解度
B.t1℃时,将a、b两种物质的溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C.将t2℃时b的不饱和溶液降温至t1℃,不一定能得到b的饱和溶液
D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在电缆生产过程中,不可避免地会产生一定量的含铜废料(废料中电缆皮和其它杂质不参与化学反应也不溶于水)。某化学兴趣小组的同学得知这一情况后,想回收利用含铜废料,根据工业制备硫酸铜的流程做了如下实验:
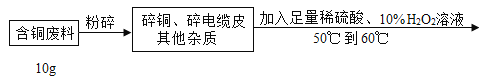
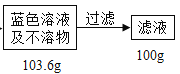
查阅资料:Cu+H2SO4+H2O2![]() CuSO4+2H2O
CuSO4+2H2O
(1)将废料粉碎的目的是_____;过滤操作中玻璃棒的作用:_____。
(2)滤液中硫酸铜的质量分数_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国是最早发明火药的国家。据史书记载,我国古代的炼丹家在长期炼制丹药过程中,发现硝、硫磺和木炭的混合物点燃时会发生爆炸,其反应原理是:2KNO3+S+3C![]() K2S+N2↑+3CO2↑,下列有关该反应说法正确的是( )
K2S+N2↑+3CO2↑,下列有关该反应说法正确的是( )
A. 反应前后元素的化合价都发生了改变
B. 该反应中没有氧气参加,不属于燃烧
C. 反应生成大量气体,放热,体积急剧膨胀,引起爆炸
D. 反应物和生成物中均有单质和化合物,属于置换反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。某研究小组采用如图实验流程用Na2CO3溶液吸收SO2制备Na2SO3。
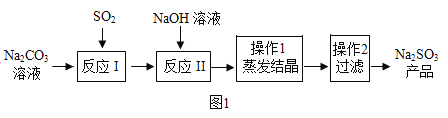
反应I中随着SO2的增加,依次发生如下化学反应:
SO+H2O+2Na2CO3=Na2SO3+2NaHCO3
SO2+2NaHCO3=Na2SO3+2CO2↑+H2O
SO2+H2O+Na2SO3=2NaHSO3
(1)H2SO3的名称为亚硫酸,则Na2SO3的名称为_____。
(2)常用蒸发结晶的方法分离混合溶液得到Na2SO3,由此可知,Na2SO3的溶解度曲线是与题图2中的_____(填A或B)物质的溶解度曲线相似。
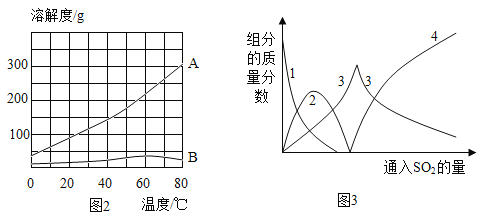
(3)操作2得到的滤液中一定含有的溶质的化学式为_____。
(4)查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如图2所示。则线1表示_____(填化学式,下同)的质量分数的变化情况,线2表示_____的质量分数的变化情况。
(5)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应1中生成的 NaHSO3转化为Na2SO3,则该化学反应方程式为_____。
(6)实验后,将Na2SO3样品放置在烧杯中,一段时间后,检测发现样品中出现Na2SO4杂质,且放置时间越长产生的Na2SO4越多,则Na2SO3样品变质为Na2SO4的化学反应方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法不正确的是
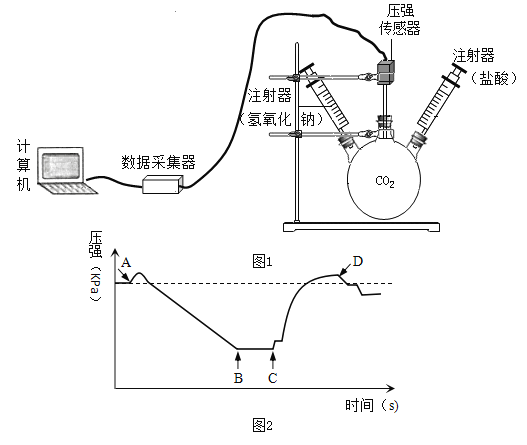
A.先推入的是NaOH溶液
B.BC段,CO2与NaOH反应基本停止
C.D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多
D.最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学习小组同学欲利用绿色粉末碱式碳酸铜[Cu2(OH)2CO3]制备金属铜,并进行相关的实验。
[实验一]制备氧化铜并检验产物,装置如下图所示(省略夹持仪器)。
步骤一:打开弹簧夹,通入氮气。
步骤二:关闭弹簧夹,将A、B、C装置连接,并开始加热至A中固体质量不变,停止加热。
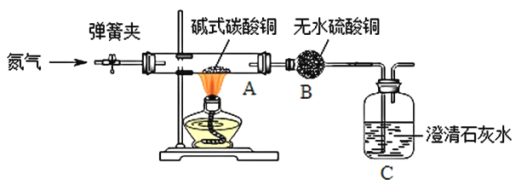
通入氮气的作用是________________;实验过程中,观察到A中有黑色固体生成,B中无水硫酸铜变蓝色、C中澄清石灰水变浑浊。碱式碳酸铜受热分解除了生成氧化铜,还生成了________________。装置C中反应的化学方程式为________________。
[实验二]用[实验一]中产生的氧化铜制备金属铜。
方法1:用一定量碳粉与[实验一] 中产生的氧化铜加热制取铜并检验产物。

实验过程中,观察到G中溶液变浑浊。E 中试管内固体反应的化学方程式是________________;装置F的作用是_____________________。
实验反思:为何[实验一]中步骤二需要加热至A中固体质量不变,才停止加热。分析可能的原因是____________________。
方法2:取适量[实验一]中产生的氧化铜,依据下列实验流程制取金属铜。

步骤I中反应的化学方程式是________________,观察到的现象是________________;步骤II中滤渣的成分是________________, 在滤渣中加入过量稀硫酸反应化学方程式是________________。
实验反思:在[实验二]中,你认为方法2优于方法1的理由是________________(写一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com