

| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
分析 (1)根据酚酞遇碱变红色分析,根据反应物、生成物写出化学方程式;
(2)根据生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀和石蕊试液遇酸变红色以及活泼金属与酸反应生成氢气填写.
解答 解:(1)①酚酞遇碱变红色,所以氢氧化钠溶液使酚酞试液变红;
②氢氧化钠与稀硫酸反应生成硫酸钠和水,随着稀硫酸滴入,烧杯溶液中减少的离子是氢氧根离子,增加的离子是硫酸根离子;
(2)因为NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4,而石蕊试液遇酸变红色,所以方案二正确,因为活泼金属与酸反应生成氢气,所以可以加入锌粒等活泼金属(或碳酸钠等),若有气体放出,证明稀硫酸过量,反之稀硫酸不过量;
故答案为(1)①红;②氢氧根离子;硫酸根离子;
(2)③方案二;④NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4;⑤锌粒(或碳酸钠等).
点评 本题考查了酸碱中和反应,要完成此题可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
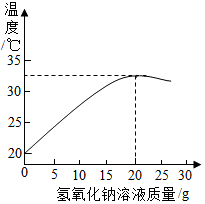 某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.| 同 学 | 实 验 操作 | 现 象 |
| 甲 | 将稀盐酸慢慢滴入加有酚酞的NaOH溶液,并不断搅拌 | 溶液颜色的变化是红色逐渐变浅直至褪去 |
| 乙 | 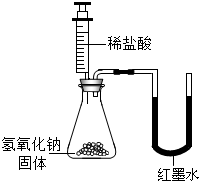 | U型玻璃管中左边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
| 丙 | 用pH试纸pH试纸测定氢氧化钠溶液的pH,向其中滴加过量稀盐酸,再测定溶液的pH | 最后溶液的pH<<(填“>7”“<7”或“=7”) |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 设计目的 |
| 将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油. | 验证空气中的氧气和二氧化碳能否影响酚酞试液变色 |
| 实验方法 | 可能观察到的现象 | 相应结果或结论 |
| 把相同质量的氢氧化镁分别放入盛有等量热水的试管中,一个试管保持温度不变,一个试管自然降温 | 保持温度不变的试管中不褪色,自然降温的试管中褪色 | 热水中的氢氧化镁能使酚酞试液变红色,冷水中的氢氧化镁不能使酚酞试液变色 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com