
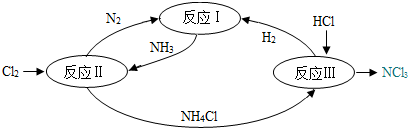
分析 (1)化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变;
(2)根据反应物、生成物的种类可以判断反应类型;
(3)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式.
解答 解:(1)氮元素在不同的物质中存在循环,体现了化学反应前后元素种类不变.
故填:元素种类.
(2)反应II中,发生反应的化学方程式为:8NH3+3Cl2=6NH4Cl+N2,属于置换反应.
故填:置换反应.
(3)反应III中,NH4Cl和HCl反应生成了NCl3和H2,发生反应的化学方程式为:NH4Cl+2HCl═NCl3+3H2.
故填:NH4Cl+2HCl═NCl3+3H2.
点评 化学反应前后,元素种类不变,原子种类也不变,因此(1)也可以填原子种类或元素和原子种类,要注意理解.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CO2气体(CO) | 过量的氧气 | 点燃 |
| B | Fe2O3(Fe) | 足量的盐酸 | 过滤 |
| C | FeSO4溶液(CuSO4) | 足量的锌 | 过滤 |
| D | O2(H2O) | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
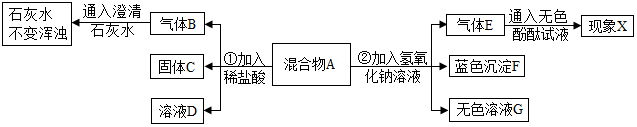
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
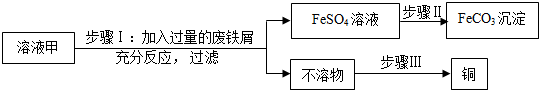
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
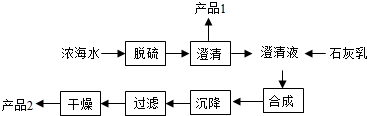
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
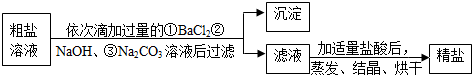
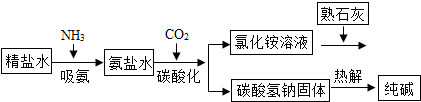
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
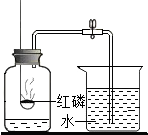
| A. | 实验前一定要检查装置的气密性 | |
| B. | 该实验得出的结论是氧气占空气总体积的$\frac{1}{5}$ | |
| C. | 燃烧的红磷熄灭后,立刻打开止水夹 | |
| D. | 实验时红磷一定要过量,并预先在集气瓶底放少量的水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com