
| 物质 | A | B | C | D |
| 反应前质量/g | 10 | 10 | 10 | 2 |
| 反应后质量/g | 待测 | 2 | 21 | 2 |
分析 首先根据质量守恒定律确定待测数值,然后将数据处理加工,一般处理方式是表格加上一行,求算变化量(后减去前,+为生成物,-为反应物,不变为杂质或者催化剂).
解答 解:根据质量守恒定律可得,待测=10g+10g+10g+2g-2g-21g-2g=7g.
数据处理如下:
| 物质 | A | B | C | D |
| 反应前质量/g | 10 | 10 | 10 | 2 |
| 反应后质量/g | 7 | 2 | 21 | 2 |
| 变化量(后-前) | -3 | -8 | +11 | 0 |
点评 此类题目中不会出现复分解反应或者置换反应,因为反应类型判断中,以上两个反应类型需要特别强调物质的类型(单质或者是化合物).


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 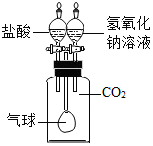 确认 CO2 和 NaOH 已发生反应 | B. | 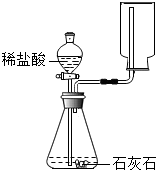 制取并收集 CO2 气体 | ||
| C. | 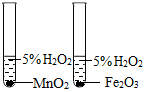 比较 MnO2 和 Fe2O3的催化效果 | D. | 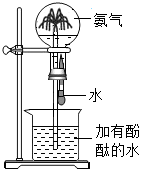 形成蓝色喷泉 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 澳大利亚工程师研制出新型太阳能电池,采用新型太阳能电池的路灯将极大提高能量转换效率.
澳大利亚工程师研制出新型太阳能电池,采用新型太阳能电池的路灯将极大提高能量转换效率.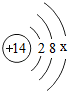 ,其中x=4.
,其中x=4.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
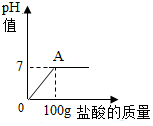 在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:
在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KOH、Ba(OH)2、NaCl | B. | NaNO3、HCl、CaCl2 | C. | NaOH、HCl、NaCl | D. | NaOH、HCl、H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 洒水车在路面洒水降尘 | B. | 禁止露天焚烧秸秆 | ||
| C. | 建筑工地要覆盖防尘膜 | D. | 大力发展火力发电 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
方案 | 实验操作 | 实验现象 | 结论 |
| 取少量滤液于试管中,在滤液中加入适量的稀盐酸. | 无白色沉淀生成 | 猜想①成立 | |
| 有白色沉淀生成 | 猜想②成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com