
将4.6g某化合物放入氧气中完全燃烧,生成8.8g二氧化碳和5.4g水,问:这种化合物含有哪几种元素?4.6g该化合物中各元素的质量分别是多少?
|
名师导引:本题属于根据已知的生成物的质量求反应物元素种类的质量问题.由质量守恒定律可知,该化合物中肯定含有碳、氢两种元素,且与生成的二氧化碳和水中所含碳、氢两种元素相等.这样,可迅速算出4.6g该化合物中碳、氢元素的质量,然后再与该化合物的总质量相比,即可知是否含有氧元素,并计算出其质量. 解答:4.6g该化合物中含碳、氢元素的质量分别为: 碳:8.8g× 氢:5.4g× 显然,4.6g>(2.4g+0.6g),根据质量守恒定律可知,该化合物还含有氧元素,其质量为:4.6g-(2.4g+0.6g)=1.6g 因此,该化合物含有碳、氢、氧三种元素,4.6g该化合物中各元素的质量分别为2.4g、0.6g、1.6g. |


科目:初中化学 来源:化学教研室 题型:038
将
4.6g某化合物放入氧气中完全燃烧,生成8.8g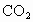 和5.4g
和5.4g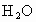 .问:这种化合物里含有哪几种元素?4.6g该化合物中各元素的质量分别是多少?
.问:这种化合物里含有哪几种元素?4.6g该化合物中各元素的质量分别是多少?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com