
【题目】元素周期表是学习和研究化学的重要工具,溴元素的相关信息如图一所示,回答下列问题:
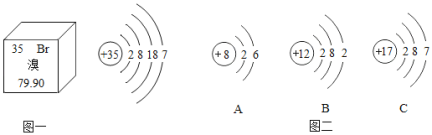
(1)溴的相对原子质量是_____;
(2)溴元素的原子在化学反应中容易_____电子(填“得到”或“失去”),其化学性质与图二中_____(填序号)元素的化学性质相似。
(3)溴元素与图二中B元素形成化合物的化学式是_____。
(4)图二中A元素的原子形成离子,其符号是_____。
【答案】79.90 得到 C MgBr2 O2﹣
【解析】
(1)溴的相对原子质量是79.90。故填:79.90。
(2)溴元素的原子最外层电子数是7,在化学反应中容易,得到电子,其化学性质与图二中氯元素的化学性质相似,这是因为溴元素和氯元素的最外层电子数都是7。故填:C。
(3)图二中B元素是镁元素,反应中容易失去2个电子形成+2价的镁元素,溴元素最外层电子数是7,反应中容易得到1个电子形成﹣1价的溴元素,由于化合物中元素化合价代数和为零,因此镁元素和溴元素形成的化合物的化学式是MgBr2。故填:MgBr2。
(4)图二中A元素是氧元素,反应中容易得到2个电子形成带2个单位负电荷的氧离子,可以表示为O2﹣。故填:O2﹣。


科目:初中化学 来源: 题型:
【题目】图一为甲、乙两种物质(不带结晶水)的溶解度曲线图。

①图一中M交点的含义是 ⑻ 。
②t1℃时,100g甲物质的饱和溶液中含有 ⑼ g甲。
③升高温度能够使其饱和溶液转化为不饱和溶液的是 ⑽ (填“甲”或“乙”)。
④在t1℃时,A、B两烧杯中均盛有20g水,分别加入等质量的甲、乙两种物质,搅拌后如图二所示,将两个烧杯中的溶液升温至t2℃,有关A、B两烧杯中的情况,下列描述正确的是 ⑾ 。
Ⅰ.溶质质量:A可能等于B
Ⅱ.溶剂质量:A一定等于B
Ⅲ.溶液质量:A一定大于B
Ⅳ.溶质质量分数:A可能等于B
Ⅴ.溶液状态:A一定不饱和,B一定饱和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图实验装置图,回答问题
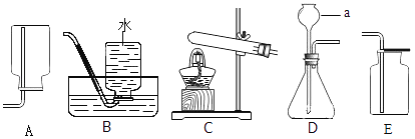
(1)图中仪器a的名称是_____.
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气,反应的化学方程式为_____,制取并收集的装置为____(填字母).
(3)实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式为____,制取并收集的装置为____(填字母),该反应生成的二氧化碳中常混有少量氯化氢气体,通过盛有碳酸氢钠溶液的洗气瓶可除去氯化氢,反应的化学方程式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国古代掌握了多种金属冶炼技术。
(1)春秋时期,发明了冶铁技术,其方法是将赤铁矿(主要成分为Fe2O3)与木炭交错堆积,利用自然风力进行燃烧,木炭不完全燃烧产生的CO将矿石中的Fe2O3还原成铁,该反应的化学方程式为____。
(2)2015年,海昏侯墓出土了大量的青铜器,其表面有绿色的铜锈,其主要成分为碱式碳酸铜[Cu2(OH)2CO3]。试推测铜生锈是铜与氧气、水、____共同作用的结果。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
火力发电厂常用石灰石浆吸收废气中的二氧化硫,以防止空气污染。反应化学方程式为: 2CaCO3+O2+2SO2===2CaSO4+2CO2若处理含有1.6 kg二氧化硫的废气,至少需要碳酸钙的质量为________ kg才能将其完全吸收。 | 原煤中含有硫,燃烧时生成的SO2会污染空气。测量SO2含量的化学方程式为:SO2+2H2O+I2=== H2SO4+2HI,取用原煤燃烧产生的工业废气样品1 m3,缓缓通过含碘(I2)1.27 mg的碘溶液,刚好完全反应。则该工业废气中SO2的含量为____mg/m3(假设工业废气中的其它物质不与碘反应)。 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源、水和溶液与人们的生活息息相关。
(1)目前人们利用最多的化石燃料是煤、_____和石油。
(2)车用乙醇汽油可适当节省石油资源,并在一定程度上减少汽车尾气的污染,乙醇燃烧的化学方程式为_____。
(3)检验水是硬水还是软水,可用的物质是_____,日常生活中使硬水软化的方法是_____。
(4)表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 20 | 40 | 50 | 60 | 80 | |
溶解度/g | KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
K2CO3 | 110 | 114 | 121 | 126 | 139 | |
Ca(OH)2 | 0.17 | 0.16 | 0.14 | 0.12 | 0.09 | |
①80℃时,KNO3的溶解度_____K2CO3的溶解度(填“>”、“=”或“<”)。
②50℃时,200g饱和K2CO3溶液蒸发10g水后,再降温到50℃,可析出K2CO3晶体的质量是_____g。
③将100g 60℃的Ca(OH)2饱和溶液降温至20℃,溶液中溶质的质量_____(填“变大”、“不变”或“变小”)。
④40℃时,向两个分别盛有相同质量的KNO3和K2CO3的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图所示。下列有关说法中,正确的有_____(填序号)。
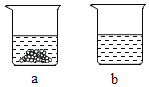
A 烧杯a中溶质是KNO3,烧杯b中溶质是K2CO3
B 烧杯b中溶液一定是不饱和溶液
C 降低温度或蒸发都有可能使烧杯b中析出固体
D 若将烧杯a中的溶液变为不饱和溶液,溶液中溶质质量分数定会减小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是无结晶水合物的固体甲和乙在水中的溶解度曲线,请根据该曲线图回答下列问题:
(1)20°C时,150g水中溶解_________g甲物质恰好形成饱和溶液。
(2)现有60℃的乙的饱和溶液,与该溶液有关的量有:
A.水的质量
B.溶液中溶质的质量
C.溶液的质量
D.乙的质量分数
E.60℃时乙的溶解度
①保持温度不变,将该饱和溶液稀释,不变的量是______(填序号,下同);
②如果将该饱和溶液降温至20℃,不变的量是_____。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象不能正确反映对应变化关系的是( )
A.  表示向pH=2的盐酸中不断加入NaOH溶液
表示向pH=2的盐酸中不断加入NaOH溶液
B. 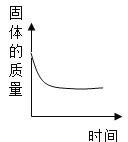 表示一定量的Fe加到AgNO3溶液中
表示一定量的Fe加到AgNO3溶液中
C. 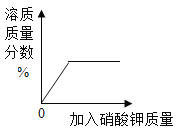 表示在20℃时,向一定量的水中不断加入KNO3晶体
表示在20℃时,向一定量的水中不断加入KNO3晶体
D. 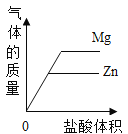 表示等质量的Mg和Zn分别加足量盐酸
表示等质量的Mg和Zn分别加足量盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过晾晒海水或者煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐.粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).工业上以粗盐为原料制取精盐,其生产流程如图所示.请回答下列问题:
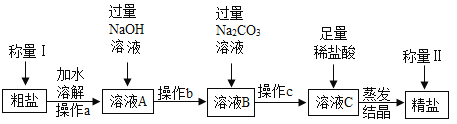
(1)已知操作a、b、c中均含同一种操作,其名称是_____.
(2)将足量稀盐酸加入溶液C中,反应的化学方程式为_____(任写一个).
(3)在蒸发操作中,用玻璃棒搅拌的作用是_____.
(4)如果称量Ⅰ中称得粗盐的质量为5g,称量Ⅱ中称得精盐的质量为5.1g,则下列分析正确的是_____.
A 精盐的产率一定为98.04%
B 精盐的产率一定为102%
C 蒸发操作中可能有水分没有蒸干
D 溶解操作中可能有粗盐没有溶解
E 除杂过程中有NaCl生成
(5)农业生产常用溶质的质量分数为10%~20%的氯化钠溶液来选种.现将100g5%的氯化钠溶液变成质量分数为20%的氯化钠溶液,需要再加氯化钠的质量是_____g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com