
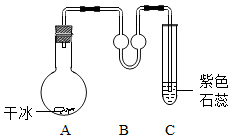
 常温下进行如图所示实验.
常温下进行如图所示实验. 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:初中化学 来源: 题型:填空题
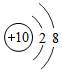 氖原子第一层电子层上有2个电子;
氖原子第一层电子层上有2个电子;| 1个水分子 | 2个氢原子 | 3个氧离子 | 4个钾原子 |
| H2O | 2H | 3O2 | 4K |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
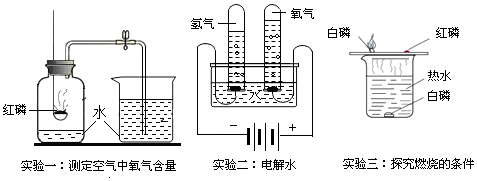
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 同种分子构成的物质是纯净物,纯净物一定由同种分子构成 | |
| B. | 某物质燃烧生成CO2和H2O,该物质中一定含有C、H、O元素 | |
| C. | 置换反应生成单质和化合物,生成单质和化合物的反应一定是置换反应 | |
| D. | 某化肥与熟石灰研磨,无刺激性气味,该化肥一定不是铵态氮肥 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 室温 | 100 | 550 | 1400 |
| B装置/g | 200.00 | 201.80 | 205.04 | 205.04 |
| C中铜网/g | 100.00 | 100.00 | 100.00 | 101.28 |
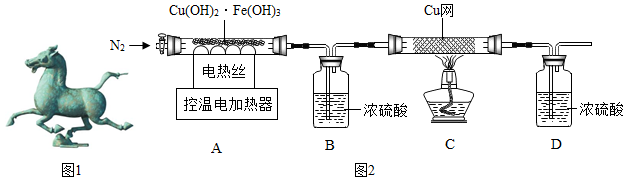
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | PM2.5是造成空气污染的主要污染物之一 | |
| B. | 空气是一种十分重要的天然资源 | |
| C. | 空气中各种成分的含量是相对稳定的 | |
| D. | 按质量计算,空气中含有氮气约78%,氧气约21% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com