
| 111 |
| 106 |
| x |
| 53g×20% |
| 106 |
| 117 |
| 53g×20% |
| y |
| 106 |
| 100 |
| 53g×20% |
| z |
| 30.6g |
| 306g |


 小学教材全测系列答案
小学教材全测系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
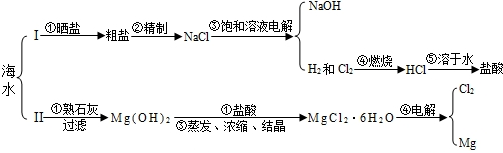
| OH- | Cl- | SO42- | CO32- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
| 配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500g 成分表:氯化钠≥88% 钙(以Ca计)(0.5-1.3)% 碘(以I计)(20-50)mg/kg |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:专项题 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com