
| 实验内容 | 实验设计 | |
| A | 除去铜粉中少量的铁粉 | 加入足量的稀硫酸,过滤,蒸发 |
| B | 提纯含有少量NaCl的KNO3固体 | 先加入水溶解,蒸发结晶 |
| C | 区分NH4HCO3和NH4Cl | 取样,加稀盐酸,观察是否有气泡产生 |
| D | 分离CO2和CO混合物 | 先用NaOH溶液吸收掉CO2分离出CO,再向剩余溶液中加浓盐酸,即可“释放”出纯净的CO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
B、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾溶解度受温度影响较大,而氯化钠受温度影响较小,据此进行分析判断.
C、根据碳酸氢铵能与稀盐酸反应生成二氧化碳气体,进行分析判断.
D、根据二氧化碳能与氢氧化钠溶液反应,碳酸钠能与盐酸反应,浓盐酸具有挥发性,进行分析判断.
解答 解:A、铁粉能与稀硫酸反应生成硫酸亚铁溶液和氢气,铜粉不能与稀硫酸反应,应再过滤、洗涤、干燥,故选项实验设计不能达到目的.
B、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾溶解度受温度影响较大,而氯化钠受温度影响较小,所以可采取加热水溶解配成饱和溶液、冷却热饱和溶液使KNO3先结晶出来、再过滤的方法;不能采用蒸发结晶的方法,否则得到的还是两者的混合物;故选项实验设计不能达到目的.
C、碳酸氢铵能与稀盐酸反应生成二氧化碳气体,NH4Cl不与稀盐酸反应,可以鉴别,故选项实验设计能达到目的.
D、分离CO2和CO混合物,二氧化碳能与氢氧化钠溶液反应,先用NaOH溶液吸收掉CO2分离出CO;再向剩余溶液中加浓盐酸,碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,但浓盐酸具有挥发性,“释放”出的二氧化碳气体中混有氯化氢气体,故选项实验设计不能达到目的.
故选:C.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
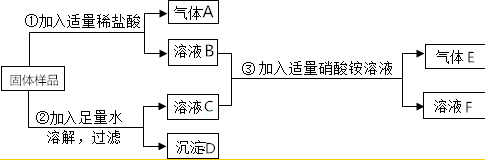
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
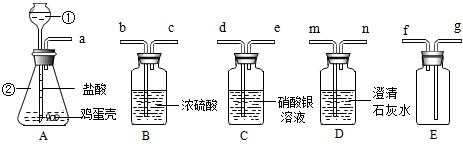
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验次数 | 氧化铜/g | 硫酸溶液/g | 硫酸铜/g |
| 1 | 2.0 | 120 | 4.0 |
| 2 | 4.0 | 120 | 8.0 |
| 3 | 6.0 | 120 | 9.6 |
| 4 | 8.0 | 200 | 16 |
| 5 | 10.0 | 200 | X |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
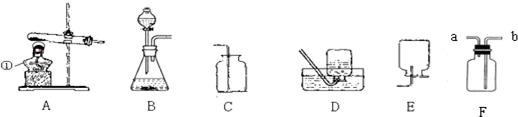
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 溶解度曲线是物质溶解性的直观体现.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
溶解度曲线是物质溶解性的直观体现.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )| A. | b物质可能是熟石灰 | |
| B. | a物质的溶解度大于b物质 | |
| C. | 使c物质结晶析出可以采用降温的方法 | |
| D. | t2时a、b两种物质饱和溶液的溶质质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
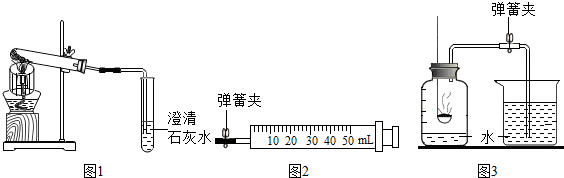
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com