将15.55g氯化钙和碳酸钙的混合物加入26.85g水中,然后向其中加入若干克10%的稀盐酸,恰好完全反应,生成了4.4g二氧化碳气体.求:
(1)原混合物中碳酸钙的质量.
(2)加入稀盐酸的质量.
(3)反应后所得溶液中溶质的质量分数.
【答案】
分析:根据化学方程式进行计算,首先必须找出相关的一种纯净物(反应物或生成物)的质量,然后根据这种纯净物的质量求出其他相关的未知量;求反应后所得溶液的质量可以根据加入物质的总质量(必须为形成溶液做贡献的,若是不溶于水也不参与反应的杂质不能加入在内)减去生成的气体或沉淀的质量来求.
解答:解:从题中不难看出碳酸钙和稀盐酸反应生成的二氧化碳的质量是4.4g,因此可以根据二氧化碳的质量求出混合物中碳酸钙的质量、稀盐酸的质量和生成的氯化钙的质量;由于所得溶液中的溶质有两个来源:①反应生成的氯化钙,②混合物中的氯化钙
,因此两部分氯化钙都要计算在内,而所得溶液的质量就是加入的氯化钙和碳酸钙的混合物的质量加上加入的水的质量,然后再加上加入的稀盐酸的质量,减去生成二氧化碳的质量.故答案为:
设原混合物中碳酸钙的质量为x,加入的稀盐酸的质量为y,生成的氯化钙的质量为z.
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 73 111 44
x y×10% z 4.4g
(1)
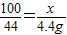
x=
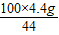
=10g
(2)
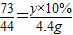
y=
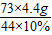
=73g
(3)
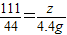
z=

=11.1g
所得溶液中溶质的质量分数为

×100%=15%
答:(1)原混合物中碳酸钙的质量为10g
(2)加入的稀盐酸的质量为73g
(3)反应后所得溶液中溶质的质量分数是15%
点评:本题难度较大,主要考查了以化学方程式计算为基础,同时融入溶液等方面的计算题,这样的题目一直是中考的热点,主要培养学生的综合分析能力和计算能力.

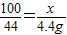 x=
x=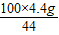 =10g
=10g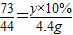 y=
y=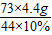 =73g
=73g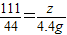 z=
z= =11.1g
=11.1g ×100%=15%
×100%=15%
