


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:初中化学 来源: 题型:
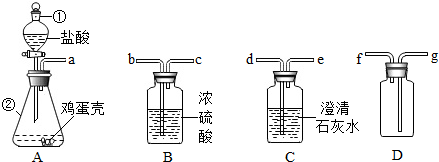
 苹果公司使用正己烷清洗液晶显示屏造成了多名员工的身体受到不同程度的毒害,正己烷的分子结构如图所示,下列关于正已烷的叙述错误的是( )
苹果公司使用正己烷清洗液晶显示屏造成了多名员工的身体受到不同程度的毒害,正己烷的分子结构如图所示,下列关于正已烷的叙述错误的是( )| A、正己烷的分子是有毒的 |
| B、正己烷分子由碳、氢两种元素质量比为36:7 |
| C、正己烷的化学式为C6H14 |
| D、正己烷是由多原子分子构成的化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:
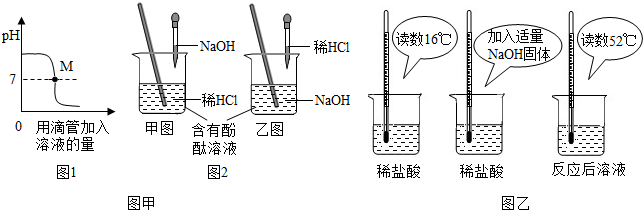
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| 实验步骤 | 实验现象 | 实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口. | 滤液中含有NH4Cl,有关化学方程式: NaOH+NH4Cl=NaCl+NH3↑+H2O | |
| ②另取少量滤液于试管中,滴加稀盐酸. | 产生无色 无味气体. |
滤液中含有 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液. | 产生白色沉淀. | 滤液中含有 |
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀. | 反应的化学方程式: |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com