



 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿 | |
| ②将几粒白色固体颗粒放入盛有少量水的试管中,并用手触摸试管外壁 | |
| ③向操作②得到的溶液中放入一段羊毛线,加热一段时间 | 羊毛线逐渐消失 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.小明用木炭代替红磷做测定空气中氧气含量的实验 |
| B.小颖用锌、铁、铜和稀盐酸确定锌、铁、铜三种金属的活动性 |
| C.小聪在20℃配制36%的氯化钠溶液(20℃时氯化钠的溶解度为36 g) |
| D.小青将过量的木炭粉和少量氧化铜粉的混合物置于蒸发皿里加强热,得到纯净的铜 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 结 论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 溶液 | | ||
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量工业烧碱样品配成溶液后,滴加过量 | | 工业烧碱中含有碳酸钠,产生实验现象的化学方程式: 。 |
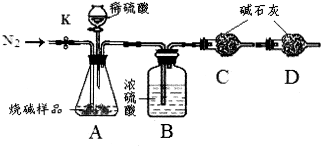
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 溶解度(20℃) | ﹤0.01g | 0.01g~1g | 1g~10g | ﹥10g |
| 物质分类 | 难溶 | 微溶 | 可溶 | 易溶 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.所有的变量都相同 |
| B.所有的变量都不相同 |
| C.实验变量不相同 |
| D.除实验变量外,其他变量均相同 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
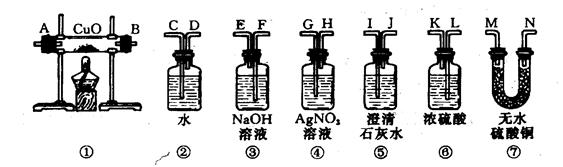
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com