
【题目】(9分)同学们在初中化学实验室中,发现一瓶如图所示久置的瓶口有白色固体、瓶塞丢失的无色溶液。已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定溶液成分,同学们进行了如下探究:

(1)探究成分
①小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是 。他取少量待测液于试管中,加入过量的稀HCl,看到 ,由此小张同学认为,溶液为Na2CO3溶液。
②小李同学对小张同学的结论提出疑问,拟进行了以下实验:取少量待测液于试管中,加入过量的BaCl2溶液,生成白色沉淀,该反应方程式为 ,过滤,取滤液,(写出还需进行的操作及现象) 。通过实验,小李认为小张结论不正确。
③同学们通过讨论认为试剂瓶原标签应该是氢氧化钠,但因吸收空气中 的而变质。
(2)测定碳酸钠的浓度
取该试剂瓶中溶液50g倒入烧杯中,再向烧杯中逐滴滴加盐酸使其充分反应至无气泡产生(假设生成的二氧化碳全部逸出)。测得加入盐酸的质量与烧杯中的物质的质量关系如下表所示。
累计加入盐酸的质量/g | 0 | 25 | 37.5 | 50 |
烧杯中物质的总质量/g | 50 | 75 | 85.3[来] | 97.8 |
请你计算:
①这一测定过程中产生二氧化碳质量为 g。
②这一瓶试剂中碳酸钠的质量分数(写出计算过程)。
【答案】(1)①一定不是氯化钠溶液,可能是氢氧化钠或碳酸钠。有气泡产生。②反应方程式为BaCl2+ Na2CO3![]() BaCO3↓+ 2NaCl,滴加无色酚酞溶液,溶液变红色或滴加硫酸铜溶液,产生蓝色沉淀(合理即可)。③CO2。(2)①2.2g。②10.6%
BaCO3↓+ 2NaCl,滴加无色酚酞溶液,溶液变红色或滴加硫酸铜溶液,产生蓝色沉淀(合理即可)。③CO2。(2)①2.2g。②10.6%
【解析】
试题分析:(1)探究成分①小张同学取待测液测得pH=10,而氯化钠溶液呈中性,pH等于7,故该溶液一定不是NaCl溶液(可能是NaOH,Na2CO3或NaOH和Na2CO3的混合溶液);滴加稀盐酸,结论是碳酸钠,碳酸钠和盐酸反应产生二氧化碳气体,故会观察到产生气泡;②取少量待测液于试管中,加入过量的BaCl2溶液,生成白色沉淀,是碳酸钠和氯化钙钡反应产生碳酸钙沉淀和氯化钠,反应的方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;过滤,取滤液,滴加无色酚酞溶液,溶液变红色或滴加硫酸铜溶液,产生蓝色沉淀等;说明含有氢氧化钠;③同学们通过讨论认为试剂瓶原标签应该是氢氧化钠,但因吸收空气中二氧化碳的而变质。(2)①根据质量守恒定律可知测定过程中产生二氧化碳质量为:50g+50g-97.8g=2.2g
②设生成2.2g二氧化碳需要碳酸钠的质量为X
Na2CO3 + 2HCl![]() 2NaCl + H2O + CO2↑
2NaCl + H2O + CO2↑
106 44
X 2.2g
106/X=44/2.2g
X=5.3g
这一瓶试剂中碳酸钠的质量分数为:5.3g/50g×100%=10.6%


科目:初中化学 来源: 题型:
【题目】(4分)锂广泛应用于电池、贮氢等领域,锂在化合物中显+1价。请结合下列示意图回答:
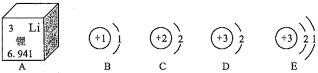
(1)请写出A中与数值有关的一条信息 ;
(2)B、C、D、E中,属于同种元素的是 ;(填字母)
(3)LiMnO2是一种电极材料,其中 Mn 元素的化合价为 ;
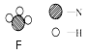
(4)写出F粒子化学式: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法错误的是
A、构成物质的粒子有分子、原子和离子
B、空气中含量最多的气体是氮气
C、一种元素在同一化合物只显示一种化合价
D、催化剂能改变化学反应的速率,而本身的质量和化学性质在化学反应前后都不会改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式表示的反应,符合实验事实的是
A.Cu+2HCl == CuCl2 +H2↑ B.Zn+2 AgCl == ZnCl2 + Ag
C.Fe +ZnSO4 ==FeSO4 + Zn D.Cu +Hg(NO3)2== Cu(NO3)2 +Hg
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)用如图6装置完成以下实验:
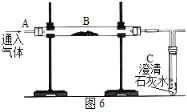
(1)探究燃烧条件:若B处盛放木炭。
Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊。
Ⅰ与Ⅲ对比,说明燃烧的条件之一是_______________;Ⅱ与Ⅲ对比,说明燃烧的条件之一是_________________。
(2)模拟工业炼铁:若B处盛放氧化铁粉末。在A处通入一氧化碳一段时间后,B处下方用喷灯加热,B处可观察到的现象为______________________________,尾气处理的方法为__________________________。《自然》杂志刊载“绿色炼铁”技术;电解熔融的氧化铁得到铁和氧气,该反应的化学方程式:_____________________,该炼铁技术另一种产物的用途为___________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)有关NaOH与CO2反应的探究
探究一:检验NaOH固体样品露置空气中一段时间后的成分
【查阅资料】Na2CO3溶液是碱性;KCl溶液、BaCl2溶液显中性、BaCO3难溶于水。
(1)检验样品是否变质。检验样品成分中是否含碳酸根的实验方法(操作、现象及结论):________________。
(2)检验样品是否完全变质。实验操作:取样品加水溶解,先加过量的_________(填编号,下同),再滴加________。
A.盐酸
B.KCl溶液
C.BaCl2溶液
D.Ba(OH)2溶液
E.酚酞试液
探究二:用NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数
【实验装置】如图8所示,向细玻璃管内注入少量水,形成一段水柱;经检查该装置气密性良好。已知细玻璃管单位长度的容积为0.1mL·cm—1。水柱的质量忽略不计。

【操作步骤】保持外界条件不变,完成以下操作:
①将40mL浓NaOH溶液迅速倒入烧瓶内,立即塞紧橡皮塞,并在细玻璃管上标记水柱底部的位置
②观察并测量得出水柱缓慢向下移动的距离为2.0cm;
③实验结束后,根据①中的标记,测得该标记以下细玻璃管及烧瓶的总容积为340mL。
(3)检查图8装置气密性的操作方法:________________________________________。
(4)仅根据本次测量数据,该气体样品中酸性气体的体积分数为________(精确到0.00001)。
(5)在上述操作步骤②中,若装置温度略有升高,实验结果______(填“偏大”、“不变”或“偏小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。
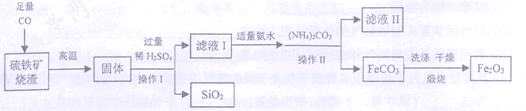
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、 等。
(2)滤液Ⅰ中主要的阳离子是 等。
(3)加适量氨水的目的是 。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是 。
(5)滤液Ⅱ中可回收的产品是 (写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
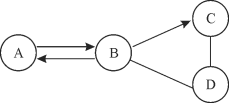
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为 ,C与D发生的化学反应 (填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为 ,写出B→C这一反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com