
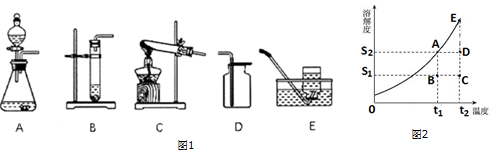
| 实验I | 实验 II |
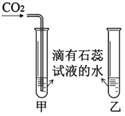 | 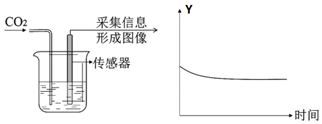 |
分析 (1)①根据空气的成分及各成分的体积分数分析回答;
②根据实验室用高锰酸钾制取氧气的原理、装置及铁丝在氧气中燃烧的注意事项分析回答;
(2)①根据变化的特征分析判断;
②根据二氧化碳能与水化合生成了碳酸分析和回答;
③根据二氧化碳溶于水及溶液的酸碱度的变化分析回答;
(3)①根据区别硬水和软水方法及水垢的性质分析判断;
②(i)根据溶解度随温度变化的情况及饱和溶液与不饱和溶液的转化方法分析回答.
(ii)根据饱和溶液具有均一性分析判断.
解答 解:(1)①空气是由不同种物质组成的,属于混合物,空气中氧气的体积分数约为21%;
②实验室用高锰酸钾制取氧气时,发生反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,属于加热固体制取气体,发生装置可选用以下如图1中的装置C.因为氧气不易溶于水,所以可以利用装置E收集.如果要做铁丝在氧气中燃烧的实验,集气瓶底部要加少量的水,用这种装置收集氧气时应注意瓶内应留少量的水.
(2)①降温将二氧化碳制成干冰,这一过程没有新物质生成,发生物理变化;
②由于二氧化碳与水反应生成碳酸,实验I中可观察到甲试管中的紫色溶液变红色,发生反应的化学方程式为:CO2+H2O═H2CO3.乙试管不变色,起到的作用是对比.
③实验II采用“数字化实验”,由传感器采集信息描绘出曲线,随着二氧化碳气体的通入溶液的酸性增强,pH减小,其中纵坐标Y可表示为烧杯中的溶液的pH;
(3)①长期饮用硬水对人体健康不利,生活中常用肥皂水来区别硬水和软水,遇肥皂水产生的泡沫少的是硬水,遇肥皂水产生的泡沫多的是软水.热水壶的内胆常附有水垢(主要成分为碳酸钙和氢氧化镁),能够与醋酸反应,可用厨房中食醋清洗水垢;
②(i)由于某固态物质的溶解度随温度的升高而增大,若将C点状态溶液变化为A点,简单的实验操作为降低温度.
(ii)取用任意体积该固态物质饱和溶液时,由于溶液具有均一性,溶液的溶质质量分数、溶液的密度不随所取体积的多少而变化.
故答为:(1)①混合物,21%;②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,C,E,瓶内应留少量的水.
(2)①物理变化;②红,CO2+H2O═H2CO3,对比,③溶液的pH;
(3)①肥皂水,C;②.(i)降低温度.(ii)CD.
点评 本题考查知识点较多,基础性强,难度不大,要熟练掌握.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:初中化学 来源: 题型:计算题
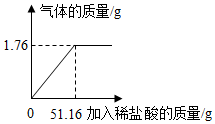 某化学兴趣小组为了测定某纯碱样品(只含有Na2CO3、NaCl)中Na2CO3质量分数,取5克样品,往其中加入一定质量的稀盐酸,产生气体的质量与所加稀盐酸的质量变化如图,试计算:
某化学兴趣小组为了测定某纯碱样品(只含有Na2CO3、NaCl)中Na2CO3质量分数,取5克样品,往其中加入一定质量的稀盐酸,产生气体的质量与所加稀盐酸的质量变化如图,试计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气可用于炼钢--氧气具有可燃性 | |
| B. | 煤矿的矿井要通风、严禁烟火--可燃性气体遇明火发生爆炸 | |
| C. | 进入久未开启的菜窖,要先做灯火试验--二氧化碳有毒 | |
| D. | 铝制品比铁制品耐腐蚀--铝比铁化学性质稳定 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验次数 | 试剂 | 实验条件 | 实验现象 |
| 1 | 0.2克CuO粉末+6毫升pH=0的盐酸 | 常温 | 黑色粉末很快溶解,溶液呈蓝绿色 |
| 2 | 0.2克CuO粉末+6毫升pH=0的硫酸 | 常温 | 无明显现象 |
| 3 | 0.2克CuO粉末+6毫升pH=0的硫酸+0.35克NaCl | 常温 | 黑色粉末很快溶解.溶液呈蓝绿色 |
| 4 | 0.2克CuO粉末+6毫升pH=0的硫酸+0.35硫酸钠 | 常温 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
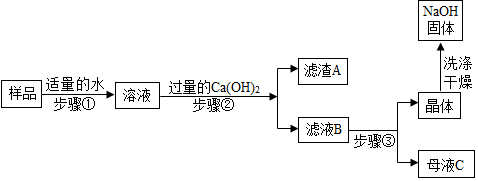
| 项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
| 样品溶液质量(g) | 10 | 20 | 30 | 40 |
| 氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
| 产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 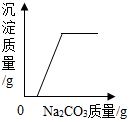 向氯化氢和氯化钙的混合溶液中加入碳酸钠溶液,生成沉淀质量的变化 | |
| B. | 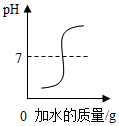 向硫酸中加水,溶液pH的变化 | |
| C. | 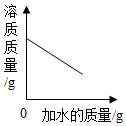 向饱和食盐水中不断加水,溶液中溶质的质量变化 | |
| D. | 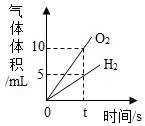 电解水生成气体的体积 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示.请计算:
某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示.请计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com