
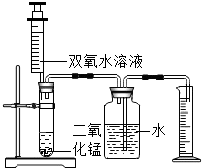
 某化学兴趣小组的同学设计了如图所示的装置,探究影响化学反应速率的因素.
某化学兴趣小组的同学设计了如图所示的装置,探究影响化学反应速率的因素.| 实验 序号 |
H2O2溶液 的浓度/% |
H2O2溶液 的体积/mL |
MnO2的 用量/g |
温度/℃ | 收集O2的体积/mL | 反应所需 的时间/s |
| ① | 5 | 2 | 0.1 | 20 | 4 | 18 |
| ② | 10 | 2 | 0.1 | 20 | 4 | 6 |
| ③ | 30 | 8 | / | 40 | 2 | 64 |
| ④ | 30 | 8 | / | 60 | 2 | 25 |


科目:初中化学 来源: 题型:

| A、x、y、z、w均为化合物 |
| B、该反应属于置换反应 |
| C、该反应中y与w的质量比为1:2 |
| D、该反应的化学方程式是2NaClO2+Cl2=2NaCl+2ClO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
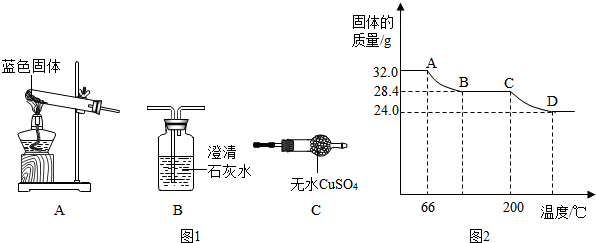
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
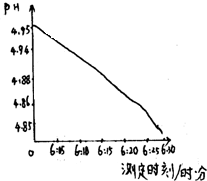 某化学课外小组在一次活动中,取刚降到地面的雨水水样,其图象如下:已知:正常与水的pH约5.6,酸雨的pH小于5.6.
某化学课外小组在一次活动中,取刚降到地面的雨水水样,其图象如下:已知:正常与水的pH约5.6,酸雨的pH小于5.6.查看答案和解析>>
科目:初中化学 来源: 题型:
| A、①为置换反应 |
| B、钴的金属活动性比铜强 |
| C、②为复分解反应 |
| D、Co(OH)2可以干燥氯化氢气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、HCl、Na2SO4、Ca(OH)2 |
| B、BaCl2、HNO3、Na2SO4 |
| C、NaCl、ZnSO4、KNO3 |
| D、CuSO4、NaOH、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、盐酸加入烧碱溶液中 |
| B、锌片浸入硫酸铜溶液中 |
| C、二氧化碳通入足量石灰水中 |
| D、三氧化硫通入氢氧化钠溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com