
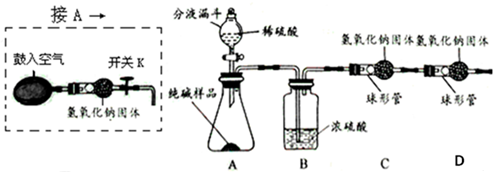
分析 (1)根据碳酸钠和硫酸反应原理书写方程式;
(2)根据浓硫酸具有吸水性,可作干燥剂分析解答,根据氢氧化钠固体的性质和D装置的作用考虑;
(3)①根据图1的用途考虑;②根据气体将反应生成的二氧化碳赶到C装置考虑;浓硫酸吸水;
(4)根据C装置质量的增加量就是生成二氧化碳的质量,根据二氧化碳的质量算出碳酸钠的质量,再除以样品的质量乘以百分之百即可;
(5)根据盐酸的挥发性考虑.
解答 解:(1)反应物是Na2CO3和H2SO4生成物是Na2SO4、H2O和CO2用观察法配平,二氧化碳后面标上上升符号,方程式是:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(2)浓硫酸具有吸水性,所以主要是除去二氧化碳中的水蒸气;D装置是防止空气中的水、二氧化碳进入C装置造成误差,因为氢氧化钠固体可与二氧化碳反应,且能吸收水分;
(3)①鼓入的空气经过了氢氧化钠,已经把空气中二氧化碳除去,用不含二氧化碳的空气排出AB装置中原有的空气,由于原有的空气中含有二氧化碳;
②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体,使反应产生的二氧化碳全部被C装置吸收;若缺少B装置,A装置中挥发出的水蒸气会一同被C吸收,使C处质量变化增大,导致纯碱的纯度偏大.
(4)C装置质量的增加量就是生成二氧化碳的质量,所以生成二氧化碳的质量为:79.6g-75.2g=4.4g,设要生成4.4g二氧化碳需要碳酸钠质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 4.4g
根据:$\frac{106}{44}$=$\frac{44}{4.4g}$
解得X=10.6g,纯碱的纯度为$\frac{10.6g}{10.8g}$×100%=98.1%;
(5)稀盐酸挥发出氯化氢气体,被C装置吸收,影响实验测定;
故答案为:
(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)除去水蒸气; 防止空气中的二氧化碳、水蒸气进入C装置;
(3)①用不含二氧化碳的空气排出AB装置中原有的空气;②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体;偏大.
(4)10.6g;98.1%;
(5)稀盐酸挥发出氯化氢气体,被C装置吸收,影响实验测定.
点评 本题考查的知识比较全面,要认真分析装置的作用,并能根据物质的性质、质量守恒定律分析解答,较好考查学生分析解决问题的能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H5OH | C. | CH3OH | D. | CH3COOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水是最常用的溶剂 | |
| B. | 溶液是由溶质和溶剂组成的 | |
| C. | 溶液的体积就是溶质的体积与溶剂体积之和 | |
| D. | 溶质的质量总是小于溶液的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学兴趣小组设计的创新实验是“火龙生字”.在成果展示现场,某同学用硝酸钾的热饱和溶液先在白纸上书写“火”字,晾干后白纸上出现硝酸钾晶体(见图1)用带火星的木条接触硝酸钾晶体,就会观察到白纸上写过字的地方燃烧并迅速蔓延,留下“火”字的黑色痕迹(见图2).在场的同学对此产生了浓厚的兴趣,并进行了如下研究:
化学兴趣小组设计的创新实验是“火龙生字”.在成果展示现场,某同学用硝酸钾的热饱和溶液先在白纸上书写“火”字,晾干后白纸上出现硝酸钾晶体(见图1)用带火星的木条接触硝酸钾晶体,就会观察到白纸上写过字的地方燃烧并迅速蔓延,留下“火”字的黑色痕迹(见图2).在场的同学对此产生了浓厚的兴趣,并进行了如下研究:| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31.6 | 63.9 | 110 | 169 | 246 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com