
合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献。合成氨的工艺流程图如下:
(1)流程中生成的氨气,在农业上是合成 肥(填化肥的种类)的原料。
(2)制取氢气的反应过程为: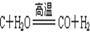 ,
,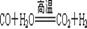 。
。
上述两个化学方程式中表现氧化性的物质是 (填化学式)。
(3)原料中N2、H2中常含有CO2和水蒸气,反应前要净化。净化过程中所用两种试剂的先后顺序为 。
(4)写出N2、H2反应生成NH3的化学方程式 。
(5)该流程中产生可循环使用的物质是 。
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:

| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

 CO+H2,CO+H2O
CO+H2,CO+H2O CO2+H2.上述两个化学方程式中表现氧化性的物质是________(填化学式).
CO2+H2.上述两个化学方程式中表现氧化性的物质是________(填化学式).| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:
合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献。合成氨的工艺流程图如下:

(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为 。
(2)制取氢气的反应过程为:C+H2O![]() CO+H2,CO+H2O
CO+H2,CO+H2O![]() CO2+H2 。上述两个化学方程式中表现氧化性的物质是 (填化学式)。
CO2+H2 。上述两个化学方程式中表现氧化性的物质是 (填化学式)。
(3)原料中N2、H2中常含有CO2和水蒸气,反应前要净化。净化的过程是
。
(4)写出N2、H2反应生成NH3的化学方程式 。
(5)将沸点不同的气体分离开来,常采用液化分离法。如,控制温度在-183℃时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在 ℃。
物质 | H2 | N2 | O2 | NH3 |
沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
查看答案和解析>>
科目:初中化学 来源:2012年广东省佛山市中考化学试卷(解析版) 题型:解答题

 CO+H2,CO+H2O
CO+H2,CO+H2O CO2+H2.上述两个化学方程式中表现氧化性的物质是______(填化学式).
CO2+H2.上述两个化学方程式中表现氧化性的物质是______(填化学式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com