
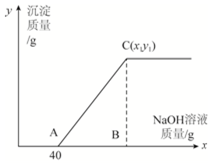
 有盐酸和氯化铜的混合溶液共100g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液,生成的沉淀与加入的10%的氢氧化钠溶液的质量关系如图所示.若氯化铜在原混合溶液中的质量分数为13.5%.求:
有盐酸和氯化铜的混合溶液共100g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液,生成的沉淀与加入的10%的氢氧化钠溶液的质量关系如图所示.若氯化铜在原混合溶液中的质量分数为13.5%.求:分析 (1)所加入的氢氧化钠溶液一部分与稀盐酸发生中和反应,另一部分与氯化铜形成氢氧化铜沉淀;根据盐酸与氢氧化钠反应的化学方程式,由反应消耗氢氧化钠的质量计算所消耗盐酸中溶质的质量,利用溶质质量分数计算式求出混合溶液中HCl的质量分数;
(2)C点的坐标(x1、y1)中x1为总共消耗氢氧化钠溶液的质量、y1为生成沉淀氢氧化铜的质量;根据氢氧化钠与氯化铜反应的化学方程式,可由氯化铜的质量计算出与之发生反应的氢氧化钠的质量及生成的沉淀氢氧化铜的质量y1;由氢氧化钠的质量与氢氧化钠溶液的质量分数计算出与氯化铜反应的氢氧化钠溶液的质量,该质量加上与稀盐酸反应氢氧化钠溶液质量40g即为整个过程所消耗氢氧化钠溶液的总质量x1.
解答 解:(1)由关系图可知,与混合溶液中盐酸发生反应的氢氧化钠溶液的质量为40g,其中氢氧化钠的质量=40g×10%=4g;
设反应消耗HCl的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
4g x
$\frac{40}{36.5}$=$\frac{4g}{x}$
x=3.65g
原混合溶液中HCl的质量分数=$\frac{36.5g}{100g}$×100%=3.65%
(2)混合溶液中含氯化铜的质量=100g×13.5%=13.5g
设反应消耗氢氧化钠的质量为y,反应生成沉淀氢氧化铜的质量为y1
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
135 80 98
13.5g y y1
$\frac{135}{13.5g}$=$\frac{80}{y}$=$\frac{98}{{y}_{1}}$
y=8g
y1=9.8g
整个过程所消耗氢氧化钠溶液的总质量x1=40g+8g÷10%=120g
答:(1)原混合溶液中HCl的质量分数为3.65%;(2)C点的坐标为(120,9.8).
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
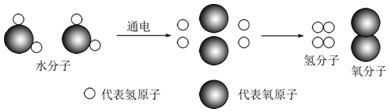
| A. | 水电解属于物理变化 | B. | 水分子是由氢分子和氧分子构成的 | ||
| C. | 水是由原子直接构成的 | D. | 分子和原子都是构成物质的微粒 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | B. | FeCl3+3NaOH═Fe(OH)3↓+3NaCl | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体先通过饱和碳酸氢钠溶液,再通过澄清的石灰水 | 澄清石灰水变浑浊 | 二氧化碳气体中混有氯化氢气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 按质量计算,空气中含有氮气约 78%,氧气约 21% | |
| B. | 空气中各种成分的含量是相对稳定的 | |
| C. | 空气是一种十分重要的天然资源 | |
| D. | PM2.5 是造成空气污染的主要污染物之一 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盛放固体药品--细口瓶 | B. | 吸取和滴加少量液体--胶头滴管 | ||
| C. | 用来量取液体--量筒 | D. | 作少量试剂的反应器--试管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com