
【题目】水是生命之源,人类的日常生活和工农业生产都离不开水。
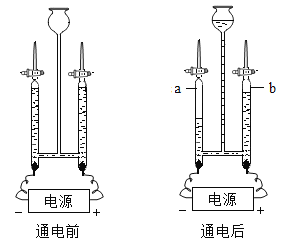
(1)如图所示的是电解水的实验过程。
①气体 a 为_________;
②通电时反应的化学方程式为_________ ;
③通电后中间球形容器内液面上升的原因是:_______。
(2)家庭用净水器利用活性炭的__________性,除去有色有味的杂质。
(3)生活中常用_________来区分硬水和软水;
(4)水也是工农业生产不可缺少的物质,合理利用和保护水资源是我们义不容辞的责任。下列做法不合理的是________(填序号)。
①严格监管化肥和农药的使用 ②积极探索污水处理的新技术 ③不间断地放水洗衣服
【答案】氢气 2H2O ![]() 2H2↑ + O2↑ a、b两管内汇聚气体,气压变大,将水压入中间球形容器中 吸附 肥皂水 ③
2H2↑ + O2↑ a、b两管内汇聚气体,气压变大,将水压入中间球形容器中 吸附 肥皂水 ③
【解析】
(1)①电解水时,正极产生氧气,负极产生氢气,体积比为1:2。由如图是电解水实验装置可知,实验过程中,试管a产生的气体体积较大,是电源的负极产生的氢气;
②水在通电条件下生成了氢气和氧气,反应的化学方程式是:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
③通电后中间球形容器内液面上升的原因是:a、b两管内汇聚气体,气压变大,将水压入中间球形容器中;
(2)活性炭具有很强的吸附性,可以吸附水中的杂质和有臭味的物质等,常用于净水;
(3)生活中可以用肥皂水区别硬水和软水,泡沫多的是软水,泡沫少的是硬水;
(4)①严格监管化肥和农药的使用,可以防止水污染,保护水资源,故①正确;
②积极探索污水处理的新技术,能防止水的污染,故②正确;
③不间断地放水洗衣服,会造成水的浪费,故③错误。故选③。


科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
IA | 0 | |||||||
1 | 1 H 氢 1.008 | 2 He 氦 4.003 | ||||||
IIA | IIIA | IVA | VA | VIA | VIIA | |||
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
请根据相关信息与知识回答:
(1)1869年,_____(填序号)发现了元素周期律并编制了元素周期表;
A 拉瓦锡 B 张青莲 C 门捷列夫 D 道尔顿和阿伏加德罗
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为_____。
(3)表中不同种元素最本质的区别是_____(填序号):
A 相对原子质量不同 B 质子数不同 C 中子数不同
(4)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:_____(填字母序号)
A 从左到右,各元素原子的电子层数相同
B 从左到右,各元素原子的最外层电子数依次增加
C 从左到右,各元素原子的最外层电子数相同
(5)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易_____(填“得到”或“失去”)电子,其离子符号为_____。说明元素的化学性质与原子的_____关系密切。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学,根据下图所示装置回答有关问题:
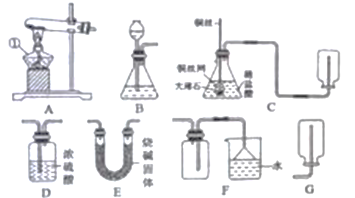
(1)仪器①的名称是__________。
(2)李丽同学设计了实验室制取并收集二氧化碳的装置(如图C所示),装置中出现了一处错误,你的纠正方法是__________。该装置的发生装置具有的优点是__________。锥形瓶中发生反应的化学方程式为__________。
(3)实验室利用图A所示装置制取氧气的化学方程式为__________。
(4)实验室可以用加热氯化镁和熟石灰固体混合物的方法制取氨气。已知氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水。为了制取并收集一瓶干燥的氨气,且减少对空气的污染。在上述装置中选出最佳的实验装置组合是__________(填字母编号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小梅同学学习了单质、氧化物、酸、碱、盐的性质后,发现许多不同类别的物质反应时都能产生盐,于是她构建了下图所示的知识网络图。
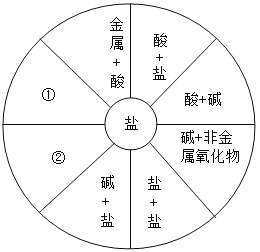
(1)请你把图中①②处补充完整(不能与图中已有信息重复)。
①_________________;②_____________________。
(2)图中部分反应不属于复分解反应的有_______。(填字母序号)
A金属+酸 B酸+盐 C酸+碱 D碱+非金属氧化物 E碱+盐 F盐+盐
(3)根据网络图可得到相关物质的反应。
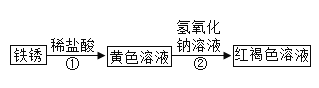
请写出下列反应的化学方程式:
①___________________;②______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是初中化学中常见的实验。

(1)A中现象:烧杯②中溶液变红。请用分子的知识解释“变红”的原因_________。
(2)B中集气瓶底部有少量水,其作用是 ______。
(3)C实验完毕,集气瓶内水面上升到一定高度后,不能继续上升,这种现象说明氮气具有______的性质;若从烧杯中进入集气瓶内水的体积明显小于瓶内原空气体积的五分之一,可能存在的原因是______。(写出一条即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取镁、碳酸镁组成的固体混合物20.4g,放入325g稀硫酸中,恰好完全反应,得到5.4g气体和溶质质量分数为20%的溶液,则原固体混合物中镁元素的质量为
A.4.8g B.9.6g C.13.6g D.16.8g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室模拟工业炼铁的装置图如图所示。

(1)写出一氧化碳与氧化铁反应的化学方程式__________________。
(2)写出硬质玻璃管中的现象__________________。
(3)写出最右侧酒精灯的作用__________________。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
【解析】
(1)由题意可知,在高温条件下,一氧化碳能与氧化铁反应,生成了铁和二氧化碳。反应的方程式是:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)由于氧化铁是红色的,生成的铁粉是黑色的。所以,硬质玻璃管中的现象是:红色粉末逐渐变黑;
(3)由于尾气中含有的一氧化碳有毒能污染空气。所以,最右侧酒精灯的作用是:点燃尾气,防止CO污染空气。
故答案为:Fe2O3+3CO![]() 2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
【题型】实验题
【结束】
25
【题目】酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有____________生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
实验操作 | 测定结果 | 白色固体成分 |
用pH试纸测定反应后溶液的酸碱度,操作方法是_______ | pH>7 | __________ |
_______ | CaCl2 |
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
①溶解、过滤和蒸发操作中都用到一种玻璃仪器是_______?该仪器在蒸发操作中的作用是_______?
②加入Na2CO3溶液的目的是______________?
③以上方案还需完善,请说明原因并加以补充_______。
(4)工业上常用NaOH溶液处理铝土矿(主要成分为Al2O3),反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O(杂质不参与反应也不溶于水)。若用160 kg NaOH配制的溶液恰好能处理340 kg铝土矿,最终得到1 004 kg NaAlO2溶液。计算:该铝土矿中Al2O3的质量分数_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一氧化碳、氢气、天然气、乙醇都可以用作燃料,分析回答。
⑴属于化石燃料的是 _________和石油、煤,是__________(填可或不可)再生能源。
⑵能实现二氧化碳零排放的燃料是_______。
⑶为防止煤气泄漏造成事故,常在煤气中添加有特殊气味的乙硫醇,这是因为一氧化碳是一种________的气体,泄露时不易察觉;乙硫醇(C2H5SH)燃烧的化学方程式为2C2H5SH + 9O2![]() 4CO2 + 2X + 6H2O,由此推测X的化学式为:_________。
4CO2 + 2X + 6H2O,由此推测X的化学式为:_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
60 | 3.3 | 62.5 | |
(1)生成氧气的质量为________.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com