写出下列反应的化学方程式并填空.
(1)稀硫酸和氢氧化钠溶液的中和反应:______;该反应属于______(填“放热”或“吸热”)反应.
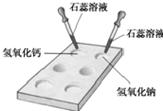
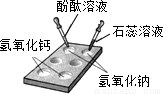
(2)在石灰水中滴加硫酸铜溶液:______;明显的现象是______.
(3)氢氧化钠固体暴露在空气中变质:______;可用______试剂来检验它已经变质.
(4)用实验证明铜的金属性比银强:______;反应类型是______.
(5)实验室加热高锰酸钾制氧气:______;在发生装置的试管口放一团棉花的作用是______.
解:(1)稀硫酸和氢氧化钠溶液反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H
2SO
4═Na
2SO
4+2H
2O;该反应属于放热反应.
(2)石灰水与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钙,反应的化学方程式为:Ca(OH)
2+CuSO
4=Cu(OH)
2↓+CaSO
4;该反应有蓝色沉淀生成.
(3)氢氧化钠固体暴露在空气中变质是因为和空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO
2+2NaOH=Na
2CO
3+H
2O;氢氧化钠溶液变质后生成的杂质是碳酸钠,检验是否变质即检验是否存在碳酸根离子,稀盐酸能与碳酸钠反应生成气体,可根据是否产生气泡能用来检验氢氧化钠是否变质.
(4)铜与硝酸银溶液反应生成硝酸铜和银,可证明铜的金属性比银强,反应的化学方程式为:Cu+2AgNO
3═Cu(NO
3)
2+2Ag;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应.
(5)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式是2KMnO
4
K
2MnO
4+MnO
2+O
2↑;在发生装置的试管口放一团棉花的作用是防止加热时高锰酸钾粉末进入导管.
故答案为:(1)2NaOH+H
2SO
4═Na
2SO
4+2H
2O;放热;(2)Ca(OH)
2+CuSO
4=Cu(OH)
2↓+CaSO
4;有蓝色沉淀生成;(3)CO
2+2NaOH=Na
2CO
3+H
2O;(4)Cu+2AgNO
3═Cu(NO
3)
2+2Ag;置换反应;(5)2KMnO
4
K
2MnO
4+MnO
2+O
2↑;防止加热时高锰酸钾粉末进入导管.
分析:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
点评:本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

 K2MnO4+MnO2+O2↑;在发生装置的试管口放一团棉花的作用是防止加热时高锰酸钾粉末进入导管.
K2MnO4+MnO2+O2↑;在发生装置的试管口放一团棉花的作用是防止加热时高锰酸钾粉末进入导管. K2MnO4+MnO2+O2↑;防止加热时高锰酸钾粉末进入导管.
K2MnO4+MnO2+O2↑;防止加热时高锰酸钾粉末进入导管.