
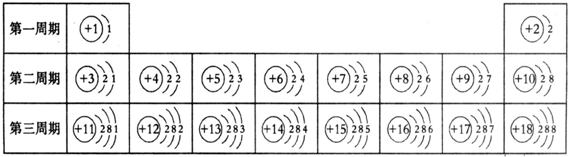
原子结构中与元素化学性质关系最密切的是
[ ]
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
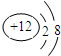
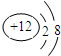
 ,若该粒子为原子,则X与Y的关系式为
,若该粒子为原子,则X与Y的关系式为查看答案和解析>>
科目:初中化学 来源: 题型:
| 元素名称 | 氟 | 氯 | 溴 | 碘 |
| 元素符号 | F | Cl | Br | I |
| 原子结构 示意图 |
 |
 |
 |
 |
| 单质化学式 | F2 | Cl2 | Br2 | I2 I2 |
| 常温常压下 | 气态 气态 |
气态 | 液态 | 固态 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:初中化学 来源: 题型:
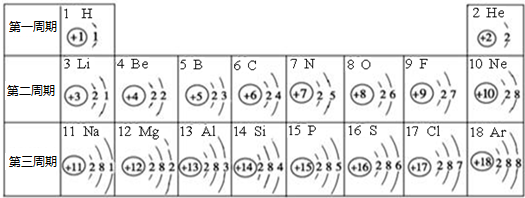
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com