
| 叶绿素 |
| 光能 |
| A、由碳、氢、氧三种元素组成 |
| B、由碳、氢两种元素组成 |
| C、含有碳、氢两种元素组成,但不能判断是否含有氧元素 |
| D、条件不足,无法推断 |


科目:初中化学 来源: 题型:
| A、蜡烛是无色、无味、透明的固体,不溶于水 |
| B、蜡烛浮于水面,说明它的密度比水小 |
| C、蜡烛在空气中燃烧有明亮的火焰,稍有黑烟,放出热量 |
| D、用指甲在蜡烛的表面轻轻一划,能出现纹迹,说明蜡烛的硬度较小 |
查看答案和解析>>
科目:初中化学 来源: 题型:
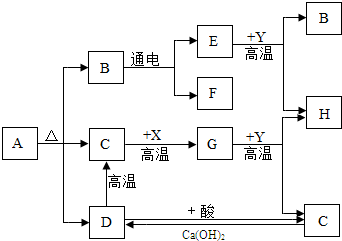 图中A、B、C、D、E、F、G、H分别代表相关反应的一种物质.已知:X、H为黑色固体单质,D是大理石的主要成分,Y为红棕色粉末.常温下C、E、F、G均为无色气体,图中有部分生成物未标出.请填写以下空白:
图中A、B、C、D、E、F、G、H分别代表相关反应的一种物质.已知:X、H为黑色固体单质,D是大理石的主要成分,Y为红棕色粉末.常温下C、E、F、G均为无色气体,图中有部分生成物未标出.请填写以下空白:| 高温 |
| Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 10 | 20 | 30 | 40 |
| 生成氢气的质量/g | 0.1 | 0.2 | 0.25 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
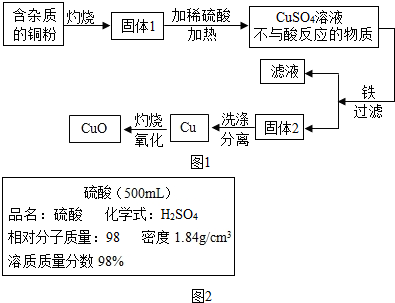
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com