
| ||
| ||
| 100 |
| 2.500g |
| 2×84 |
| x |
| 100 |
| 2.500g |
| 106 |
| y |
| 106 |
| 73 |
| z |
| 9.125g |
| 46 |
| 106 |
| w |
| 10.600g |
| 84 |
| 106 |
| x′ |
| 10.600g |
| 17.110g-4.200g-4.000g-8.400g |
| 17.110g |


科目:初中化学 来源: 题型:阅读理解
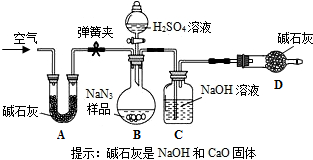
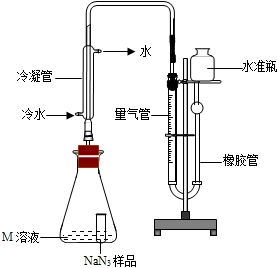
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
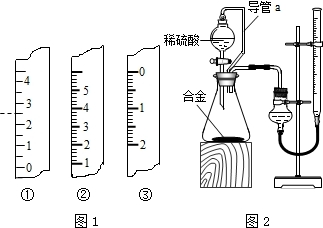
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
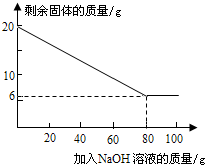 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加 足量(或过量)的NaOH溶液 足量(或过量)的NaOH溶液 ,充分反应后,静置,弃去清液得到固体. |
固体粉末 部分溶解 部分溶解 ,有 气泡放出 气泡放出 . |
仅除去铝 |
| ② | 再往大试管中加 足量(或过量)的稀硫酸(或稀盐酸) 足量(或过量)的稀硫酸(或稀盐酸) ,充分反应. |
固体 部分溶解并有气泡放出 部分溶解并有气泡放出 ,溶液 呈浅绿色 呈浅绿色 . |
证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com