
 (1)实验室现有质量分数为98%(密度:1.84g/cm3)的浓硫酸,欲将这种浓硫酸稀释为19.6%的稀硫酸184g,要这种浓硫酸体积为mL;
(1)实验室现有质量分数为98%(密度:1.84g/cm3)的浓硫酸,欲将这种浓硫酸稀释为19.6%的稀硫酸184g,要这种浓硫酸体积为mL;分析 (1)根据溶液稀释前后溶质的质量不变,结合题意进行分析解答.
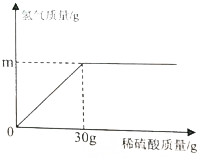
(2)锌与稀硫酸反应生成硫酸锌和氢气,铜不与稀硫酸反应,由生成氢气质量与所加稀硫酸质量之间的变化关系图,前恰好完全反应时,消耗稀硫酸的质量为30g,由反应的化学方程式,列式计算出生成氢气的质量、参加反应的锌的质量,进而计算出黄铜中铜的质量分数.
解答 解:(1)设需要这种浓硫酸体积x,根据溶液稀释前后溶质的质量不变,
则184g×19.6%=1.84g/cm3×x×98% x=20cm3=20mL.
(2)设生成氢气的质量为x,参加反应的锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑
65 98 2
y 30g×19.6% x
①$\frac{98}{2}=\frac{30g×19.6%}{x}$ x=0.12g
②$\frac{65}{98}=\frac{y}{30g×19.6%}$ y=3.9g
黄铜中铜的质量分数为$\frac{10g-3.9g}{10g}$×100%=61%.
答:(1)需要这种浓硫酸20mL;(2)①0.12;②黄铜中铜的质量分数为61%.
点评 本题难度不大,掌握根据化学方程式的计算、溶液稀释前后溶质的质量不变即可正确解答本题,解题时要注意解题的规范性.


科目:初中化学 来源: 题型:解答题
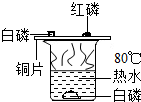 化学课上我们曾经观察过如图所示的实验.
化学课上我们曾经观察过如图所示的实验.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
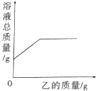 在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )| 序号 | 甲 | 乙 |
| A | HCl溶液 | Zn粒 |
| B | 石灰水 | 二氧化碳 |
| C | H2SO4溶液 | NaOH溶液 |
| D | AgNO3溶液 | Cu粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:| 试验编号 | 1 | 2 |
| 反应物 | 6%的过氧化氢 | 6%的过氧化氢 |
| 催化剂 | 1g红砖粉 | 1g二氧化锰 |
| 时间 | 152s | 35s |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
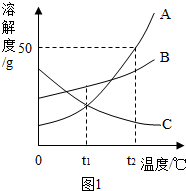 溶解是生活中常见的现象.
溶解是生活中常见的现象.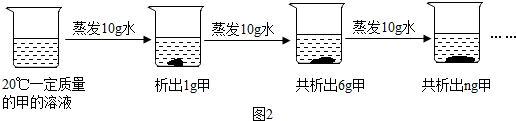
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 阴离子 | OH- | Cl- | CO32- |
| 阳离子 | |||
| Ca2+ | 微 | 溶 | 不 |
| NH4+ | 溶、挥 | 溶 | 溶 |
| 步骤 | 实验操作 | 实验现象 | 相应的结论 |
| 一 | 取样,加入稀盐酸 | ①有气泡产生 | 猜想2不成立 |
| 二 | ②加入氢氧化钠溶液 | 有刺激性气味气体生成 | 猜想③,成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com