
科目:初中化学 来源: 题型:阅读理解
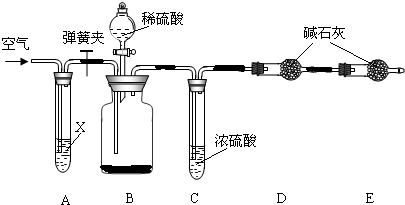
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
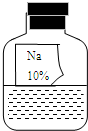 实验室里有一瓶常用的无色液体试剂,因保管不当造成标签破损(如图所示),其残缺的标签中只剩下“Na”和“10%”字样.
实验室里有一瓶常用的无色液体试剂,因保管不当造成标签破损(如图所示),其残缺的标签中只剩下“Na”和“10%”字样.| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于品试管中,滴加 稀盐酸 稀盐酸 |
产生大量的气泡 | 相应的化学方程式: Na2CO3+2HCl═2NaCl+H2O+CO2↑ Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
| 把产生的气体通入澄清石灰水中 | 白色沉淀 白色沉淀 |
猜想②正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
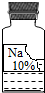 (2012?息县一模)实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).小强和小华同学很感兴趣,决定对其成分进行探究.
(2012?息县一模)实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).小强和小华同学很感兴趣,决定对其成分进行探究.| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 实验步骤 | 实验现象 | 结论及化学方程式 |
| ①取少量溶液于试管中, 滴加 稀盐酸 稀盐酸 . |
产生大量气泡 | 反应的化学方程式: Na2CO3+2HCl=2NaCl+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑ . |
| ②把产生的气体通入 澄清的石灰水中. |
澄清的石灰水变浑浊 | 猜想②正确.反应的化学方程式: CO2+Ca(OH)2═CaCO3↓+H2O CO2+Ca(OH)2═CaCO3↓+H2O |
查看答案和解析>>
科目:初中化学 来源:2011年第二十一届“天原杯”全国初中学生化学素质和实验能力竞赛(广东赛区)初赛试卷(解析版) 题型:填空题
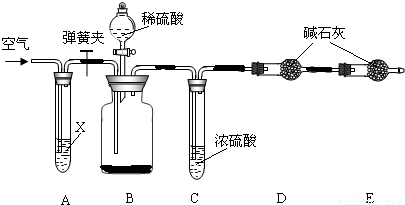
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com