


科目:初中化学 来源: 题型:阅读理解

| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- 可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- | ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. |
查看答案和解析>>
科目:初中化学 来源: 题型:
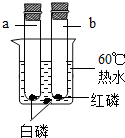 燃烧与我们的生活与社会的发展有着密切的联系.
燃烧与我们的生活与社会的发展有着密切的联系.| 现 象 | 解 释 |
| a试管中白磷燃烧,热水中的白磷没有燃烧. b试管中红磷没有燃烧. |
b试管中红磷、热水中白磷都没有燃烧的原因分别是: ① ② |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.| 溶液中可能含有的离子 | 设计实验验证 | ||
| 实验步骤 | 现象 | 结论 | |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能含SO42- 可能含SO42- |
取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. 取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. |
查看答案和解析>>
科目:初中化学 来源: 题型:
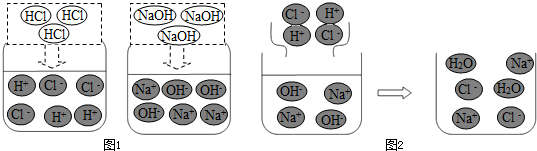
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com