
【题目】铁、铜和铝是人类生活中常用的金属。
(1)动物细胞中含量最多的金属元素是_____。
(2)用铜、铝做导线,利用了它们的_____性。
(3)铁锅易生锈,铁生锈的条件是_____。
(4)铜器表面会生成铜锈,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],该物质含有_____种元素,从它的化学式可推知,铜生锈的过程除了与氧气和水有关外,还与空气中的_____有关。
(5)除去铜器表面的铜锈时,加入过量的稀硫酸,生成二氧化碳,同时得到蓝色溶液。若再向上述蓝色溶液中加入足量的铁粉,铁粉与蓝色溶液发生反应的化学方程式为_____。
(6)为了验证锌、铁的金属活动性强弱,小琴同学将锌片和铁片同时插入稀硫酸中,而没有插入硫酸铜溶液中,其原因是_____。
(7)小明买了一种“汽泡爽”的冲调饮料,原料中的柠檬酸和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,3NaHCO3+C6H8O7=C6H5O7Na3+3H2O+3CO2↑.为了探究加水温度对产生气体量的影响,在老师的帮助下,小明采用相同的两套实验装置(如图)分别完成上述实验,在A中加入水,再加入一袋“汽泡爽”,迅速塞紧胶塞。量筒C用于收集A中产生的气体所排出的液体,冷却至室温后读取数据。B中油层的作用是_____。

【答案】钙 导电 铁与氧气、水同时接触 4 二氧化碳(或CO2) Fe+CuSO4═FeSO4+Cu、Fe+H2SO4═FeSO4+H2 将锌片、铁片放入稀硫酸中,锌片放出气泡速度比铁片快,得出锌比铁活泼;若将锌片、铁片放入硫酸铜溶液中,铁、锌与硫酸铜都反应,锌、铁表面都生成红色固体(或锌、铁的现象都相同),无法判断铁是否与硫酸锌反应,所以不能比较锌铁的活动性强弱 防止二氧化碳溶解在水中
【解析】
(1)动物细胞中含量最多的金属元素是钙。
(2)铜、铝具有导电性,可用于制导线。
(3)铁与氧气、水同时接触时会发生锈蚀。
(4)碱式碳酸铜[Cu2(OH)2CO3],该物质含有H、O、Cu、C四种元素,从它的化学式可推知,铜生锈的过程除是金属铜和氧气、水还与空气中的二氧化碳发生化合反应的结果。
(5)碱式碳酸铜[Cu2(OH)2CO3]可以和硫酸反应生成硫酸铜、水以及二氧化碳,加入金属铁,会和硫酸铜之间发生置换反应,即Fe+CuSO4═FeSO4+Cu还会和过量的硫酸之间发生反应Fe+H2SO4═FeSO4+H2↑。
(6)为了验证锌、铁的金属活动性强弱,小琴同学将锌片和铁片同时插入硫酸溶液中,而没有插入硫酸铜溶液中,其原因是:将锌片、铁片放入稀硫酸中,锌片放出气泡速度比铁片快,得出锌比铁活泼;若将锌片、铁片放入硫酸铜溶液中,铁、锌与硫酸铜都反应,锌、铁表面都生成红色固体(或锌、铁的现象都相同),所以不能比较锌铁的活动性强弱。(7)产生的二氧化碳气体是能溶于水的气体,而油层能使二氧化碳与水不接触,从而防止二氧化碳溶于水。


科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学。实验室利用如图所示装置进行相关实验,请结合下列装置图回答问题:
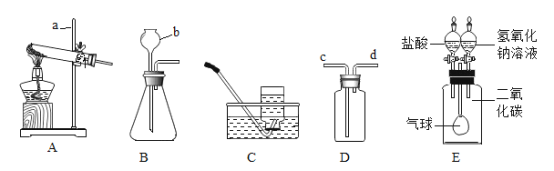
(1)写出标注仪器的名称:a____________,b______________。
(2)实验室用过氧化氢和二氧化锰制取一瓶氧气,应选择的发生装置是________________,反应的化学方程式为___________,能用C装置收集氧气的原因是______________。
(3)D装置可用于气体的收集、检验、除杂等,用该装置能完成的实验是_______________(填序号)。
①气体从d端通入,收集氢气
②瓶内装满水,氧气从c端通入,收集氧气
③瓶内装有澄清石灰水,气体从c端通入,检验氧气中是否混有二氧化碳
④瓶内装有浓硫酸,气体从d端通入,吸收氢气中混有的水蒸气
(4)E装置中的气球是“魔幻可变气球”。实验前,E装置中分液漏斗的活塞均处于关闭状态。打开__________(填“左”或“右”)边分液漏斗的活塞并轻轻振荡集气瓶,可观察到气球明显变大;为使得气球恢复原状,需进行的操作是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验室现有一包固体样品A,其中可能含有Fe、NaOH、Na2CO3、Ca(OH)2四种物质中的一种或多种。小颖同学按下图所示进行成分组成探究实验,出现的现象如图中所述。(假设所有能发生的反应都恰好完全进行)
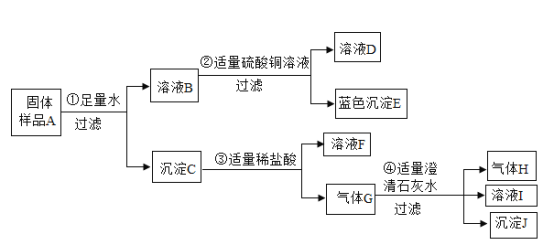
根据上述信息和分析推理,试回答下列问题:
(1)蓝色沉淀E的化学式为__________。
(2)气体H的化学式为_________,由此可推知样品A中一定含有________________。
(3)写出步骤①中反应的化学方程式___________。
(4)写出步骤③中发生的复分解反应方程式_______________,溶液F的颜色为______________。
(5)根据上述实验信息,仍不能确定是否存在的物质是______________,你的理由是:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定条件下,一定质量的乙醇与O2恰好完全反应,生成2.7gH2O、2.2gCO2和一定质量的CO,则参加反应的氧气和生成的CO的质量分别为___、___,该反应的化学方程式为___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
A.28.0g B.44.8g C.56.0g D.78.0g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
(查阅资料)获得的资料有:
补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
(方案设计和实施)根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
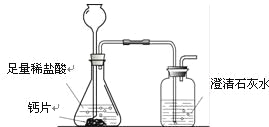
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
(分析和评价)
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用(查阅资料)(3)中介绍的方法,还需要学习的是 。
(结论)经过计算,该钙片中碳酸钙的质量分数是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D是初中化学常见的物质,它们之间的转化关系如图所示。
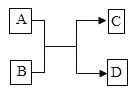
(1)若A为黑色固体单质,C为红色固体单质,B可用于配制农药波尔多液,反应的化学方程式为_________________________。
(2)若A、C均是常见的酸,且C中含有两种元素,D为不溶于水的白色固体,反应的化学方程式为_________________________。
(3)若A是一种银白色金属,在空气中燃烧产生耀眼的白光,B是会加剧温室效应的气体,C是黑色固体,A、B在点燃条件下反应生成C和D,反应的化学方程式为_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)用化学用语填空
①铝元素_____
②氦气_____
③2个二氧化氮分子_____
④镁离子_____
⑤硝酸根离子_____
⑥标出KClO3中氯元素的化合价_____
(2)写出下列数字意义:
①2CH4中“4”的含义_____
②2NH4+中“2”的含义_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是氯化钾和硝酸钾在不同温度下的溶解度。根据表中数据,请回答下列问题:
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
(1)在所示的坐标纸上绘制出氯化钾的溶解度曲线______________。
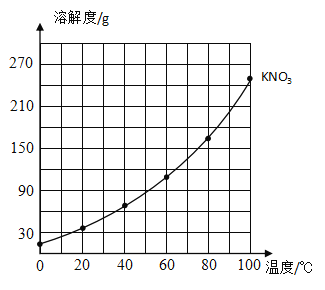
(2)比较两种物质的溶解度曲线,溶解度受温度影响变化较小的是______________,温度大约在___________°C时,两种物质的溶解度大小相等。
(3)60°C时,105g的KNO3饱和溶液中含有的溶质的质量为____________。
(4)40°C时,向烧杯中加入50g水和25gKCl固体,充分溶解后得到的溶液是_____________(填“饱和”或“不饱和”)溶液,其溶质质量分数为_____________(精确到0.1% )。
(5)若KNO3中混有少量的KCl ,提纯KNO3的方法是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com