
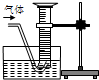
 氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜固体(含硫酸亚铁等杂质)进行如下实验:
氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜固体(含硫酸亚铁等杂质)进行如下实验:| Ⅰ |
| Ⅱ |
| Ⅲ |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:湖南 题型:问答题

查看答案和解析>>
科目:初中化学 来源:中考真题 题型:实验题
 CuSO4溶液
CuSO4溶液 CuSO4·5H2O→……→CuO
CuSO4·5H2O→……→CuO 
查看答案和解析>>
科目:初中化学 来源:2009年第十九届“天原杯”全国初中学生化学素质和实验能力竞赛(湖北赛区)初赛试卷(解析版) 题型:解答题

 CuSO4溶液
CuSO4溶液 CuSO4?5H2O→…→CuO
CuSO4?5H2O→…→CuO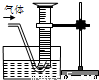
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com