
| A. | ①②③ | B. | ①②④⑤ | C. | ①②③⑤ | D. | ①②④⑤ |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:初中化学 来源: 题型:解答题
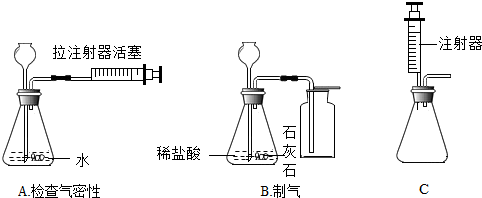
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
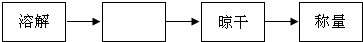
| 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ.取少量样品,加水. | 样品全部溶解 | |
| Ⅱ.取溶液于试管中,滴入足量的CaCl2溶液,过滤. | 产生白色沉淀 | 溶液中含有K2CO3. |
| Ⅲ.取Ⅱ所得的滤液于另一试管中,滴加无色酚酞试液. | 酚酞试液变红色 | 溶液中含有KOH. |
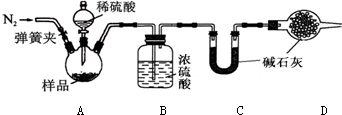
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
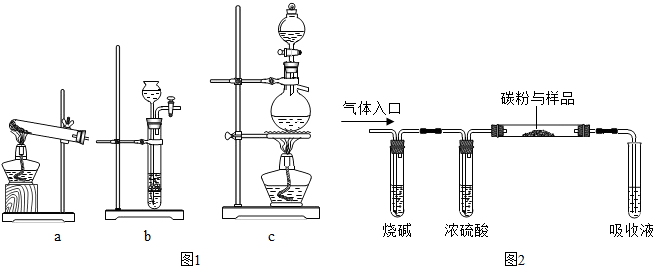
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
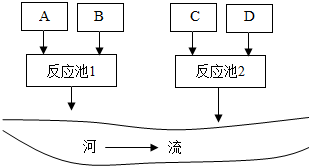 某化学试剂厂A,B,C,D四个车间排放的废水中,分别含有氢氧化钠、硫酸铜、碳酸钠、硫酸中的一种,在不加其他试剂的情况下,若控制流量,将它们排放到反应池中,使其恰好完全反应,最后可形成不污染环境的废液排入河流.如图所示:
某化学试剂厂A,B,C,D四个车间排放的废水中,分别含有氢氧化钠、硫酸铜、碳酸钠、硫酸中的一种,在不加其他试剂的情况下,若控制流量,将它们排放到反应池中,使其恰好完全反应,最后可形成不污染环境的废液排入河流.如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 提高可燃物的着火点 | B. | 增大可燃物的热值 | ||
| C. | 增大可燃物与空气的接触面积 | D. | 提高空气中氧气的含量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 元素 | B. | 单质 | C. | 分子 | D. | 原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com